새 법령 규정에 맞게 정비, 임상 설계 및 평가 기준 구체화
식품의약품안전처(처장 오유경) 소속 식품의약품안전평가원(원장 강석연)은 ‘디지털의료제품법’ 하위 규정 시행에 따라 디지털의료기기 임상시험 관련 가이드라인 9종을 31일 개정했다.

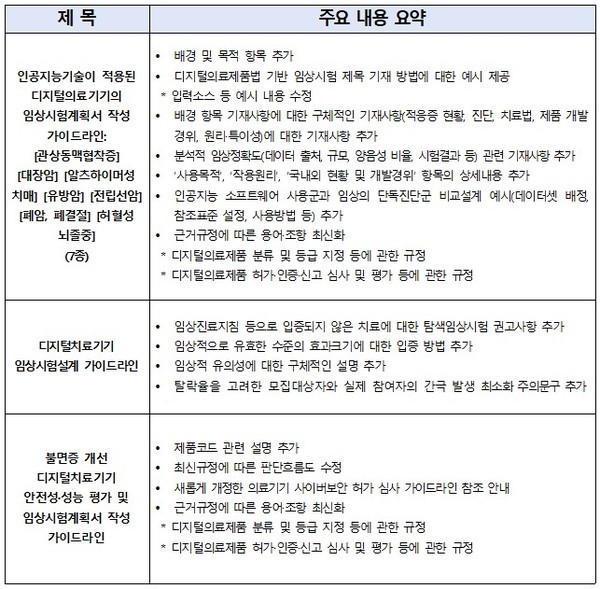
개정 대상은 △인공지능(AI) 기술이 적용된 디지털의료기기 7종(관상동맥협착·대장암·알츠하이머성 치매·유방암·전립선암·폐암·허혈성뇌졸중)의 임상시험계획서 작성 가이드라인과 △디지털치료기기 임상시험설계 △불면증 개선 디지털치료기기 안전성·성능 평가 및 임상시험계획서 작성 등 총 9종이다.
이번 가이드라인에는 디지털의료기기 소프트웨어 특성을 반영해 임상시험계획 신청서 및 첨부서류 작성 방법이 구체적으로 제시됐다. 특히 AI 기술이 적용된 기기는 △AI 소프트웨어 추가 사용군과 임상의 단독진단군 비교설계 △데이터 출처, 규모, 양·음성 비율, 시험결과 등을 포함한 분석적 임상정확도 △적응증별 유효성 평가 지표 설정 등의 세부 예시를 담았다.
또한 디지털치료기기의 경우 △전향적 임상시험 원칙 △임상 대상자 수 산출 시 주의사항 △임상적으로 유효한 효과크기 입증 방법 등을 명확히 했으며, 불면증 개선용 디지털치료기기는 제품코드 설명과 최신 규정에 따른 판단 흐름도를 보완했다.
식약처는 “이번 개정을 통해 산업계가 디지털의료기기 임상시험 절차에 대한 이해도를 높이고, 안전하고 신뢰할 수 있는 제품이 국민에게 공급되는 데 도움이 될 것”이라며 “앞으로도 전문성과 규제과학을 기반으로 산업계 지원을 강화하겠다”고 밝혔다.
제·개정된 가이드라인 전문은 식약처 누리집(www.mfds.go.kr) ‘법령/자료 → 법령정보 → 공무원지침서/민원인안내서’에서 확인할 수 있다.