이상수의 Health Policy Insight
[Health Policy Insight 506호]

메드트로닉코리아 부사장
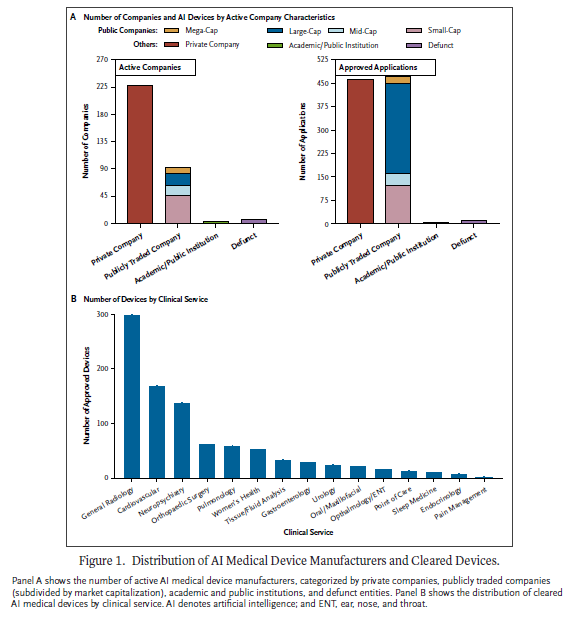
인공지능(artificial intelligence, AI)을 탑재한 의료기기(Artificial intelligence–enabled medical devices, AIMD)는 임상적 의사결정과 헬스케어 운영을 혁신하고 있다. 그러나 이런 잠재력에도 불구하고 대부분의 AIMD는 US FDA 승인을 510(k) 경로를 통해 획득하며, 이는 기존에 승인된 의료기기와 실체적 동등성(substantial equivalence)을 입증하는 것을 요구할 뿐 독립적인 임상 검증을 거치지 않는다. 이에 따라 근거의 강건성(evidentiary robustness)에 대한 우려를 제기한다. 많은 AIMD는 임상평가가 부족하며, 임상적용에서 AI가 어떻게 사용되는지에 대한 명확한 공개가 없으며, 리콜 대상이 돼 환자안전과 규제 투명성에 대한 우려를 불러일으키고 있다. AIMD와 관련된 대부분의 규제 논의는 보험급여 프레임워크(reimbursement framework)나 안전성, 유효성, 편향 완화를 촉진하는 정책 등 의료기기 수준의 전략에 초점을 맞추고 있다. 그러나 의료기기 개발은 진공 상태에서 이뤄지지 않는다. 의료기기 규제는 이를 개발하는 업체의 감독을 포함하며, 상업화 모델, 재정적 인센티브, 규제 환경은 혁신과 시장 결과에 영향을 미친다 — 이런 역학은 여전히 충분히 이해되지 않고 있다. 이 논문은 950개의 FDA 승인 AIMD의 상업화 현황을 분석하며, 제조업체 유형, AI 방법, 시판 후 안전성을 살펴보았다. 이런 추세를 정리함으로써 AIMD 제조업체의 유형과 제품 투명성 및 리콜 발생율의 변동 간의 관계를 특징짓고, 규제당국과 의료공급자가 추가적인 검토가 필요한 상업화 분야를 강조했다.
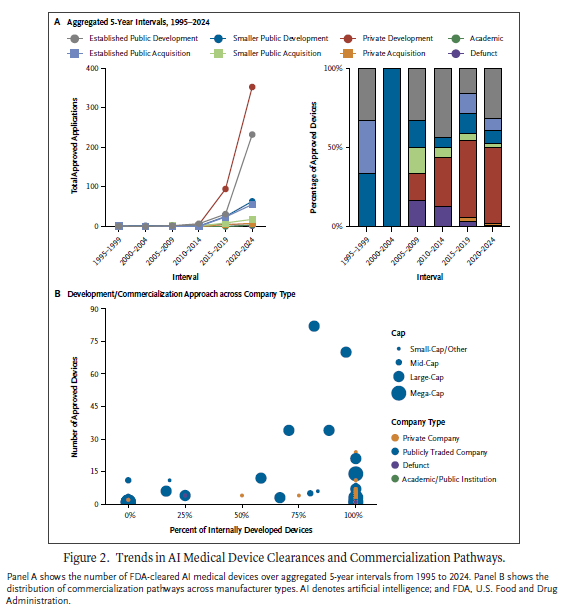
AI의 발전, 변화하는 규제 프레임워크, 시장 역동성에 힘입어 AIMD의 상업적 환경은 급속한 변화를 겪고 있다. 주로 내부 개발 및 상용화에 의해 주도된 승인 건수의 급격한 증가를 보였다. 이런 결과는 헬스케어 제공에서 AI의 변화하는 역할에 대한 중요한 식견을 제공하며, 혁신과 안전성 및 투명성을 균형 있게 조화시키려는 정책입안자, 의료 공급자, 규제기관, 산업계 리더들의 전략수립에 지침을 제공한다. AIMD 승인 건수의 증가 — 1995~2014년에 연간 평균 1.4개에서 2020~2024년에 146개로 — 는 해당 분야의 급속한 성장을 반영한다. 전체적으로 이 연구결과는 특히 민간 및 기존 기업들의 내부 개발이 AIMD 발전에 미치는 역할을 강조한다. 기존 기업들은 고급 DL 소프트웨어나 다모드(multimodal) AI 시스템을 갖춘 의료기기를 자주 인수했으며, 민간 및 소규모 기업들은 일반적으로 단순한 계산 아키텍처를 갖춘 의료기기나 소프트웨어를 인수했다. 이런 차이는 서로 다른 전략적 목표를 반영할 수 있으며, 거대 기업은 복잡한 의료기기 포트폴리오 확장을 추구하는 반면 소규모 기업은 주로 시장진입을 촉진하는 것을 목표로 한다.
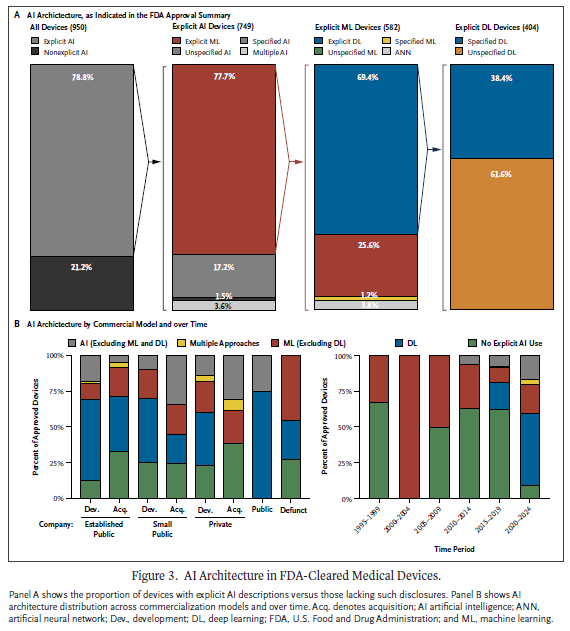
일반 영상의학은 여전히 AIMD의 주요 초점이다. 그러나 심혈관, 신경정신과, 기타 임상 및 외과 분야의 급속한 성장은 AI의 확장되는 다기능성을 강조한다. 이 추세는 전임상 및 임상연구에서 오랫동안 인정받아온 AI 적용의 다양성이 이제 시중에 출시된 승인된 의료기기로 전환되고 있음을 보여준다. 이런 결과는 격려할 만하지만, 표준화된 검토의 필요성을 강조한다. 의료기기의 사용 목적에 따라 FDA 검토 패널을 달리 지정하는 것은 실체적 동등성 또는 승인 기준에 대한 기준과 해석의 변동성을 초래한다. 검토 패널 간 엄격하고 일관된 기준을 수립하는 것이 점점 더 필수적이 되고 있다. 심층학습(deep learning, DL)은 AI의 주요 접근방식으로 부상했으며, 지난 5년간 승인된 모든 AIMD의 과반수를 차지한다. 그러나 DL 의료기기의 1/3만이 사용된 특정 테크닉을 공개하고 있어, 이런 접근방식이 제기하는 독특한 도전과제를 해결하기 위해 더 큰 투명성이 필요하다. AI 사용 기술을 명시적으로 언급하지 않은 의료기기 비율은 2015~2019에 62.4%에서 2020~2024년에 8.9%로 감소했지만, 모든 AIMD의 61.7%는 여전히 AI 방법론에 대한 상세한 설명이 부족하다. 이 명확성 부족은 이런 기술의 해석가능성과 책임성에 대한 우려를 제기하며, 승인과 시판 후 성능 간의 격차와 관련된 이슈를 악화시킬 수 있다.
마지막으로, 의료기기 리콜에 대한 검토 결과 놀라운 차이가 드러났다. 상장된 거대기업의 AIMD 중 14.4%와 상장된 소규모 기업의 AIMD 중 11.8%가 리콜됐으며, 이는 비상장기업에서 리콜된 비율인 1.3%와 대비된다. 이는 거대 상장기업과 소규모 상장기업의 경우 각각 비상장기업에 비해 승인된 AIMD당 리콜 발생률이 16배와 30배 더 높다는 것을 의미한다. 이 차이는 상장기업과 비상장기업의 상용화 경로가 품질 보증 및 규제준수 측면에서 상이한 압력을 초래할 수 있음을 시사한다. 상장기업은 더 큰 제품 포트폴리오와 주주 기대치로 인해 엄격한 시판 전 검증보다 빠른 시장진입을 우선시할 수 있으며, 이는 더 높은 리콜 발생율로 이어질 수 있다. 그럼에도 불구하고 이런 리콜은 기능적 진단오류, 환자 피해, 의료분야에서 AI 활용에 대한 신뢰 저하를 초래할 수 있다. 또한 상장기업에서 미해결 리콜 발생율이 더 높은 것은 더 지속적인 이슈와 이를 해결하는데 더 느린 대응시간과 연관돼 있을 가능성이 높으며, 이는 심각한 우려를 제기한다. 분명히 협력적인 시판 전 평가 개혁과 시판 후 감시 강화는 안전성 및 유효성 기준이 빠른 기술발전과 보조를 맞출 수 있도록 보장하는데 필수적이다. 향후 연구는 이런 차이를 조사하고, 상장기업 내 의료기기 개발에서 이런 차이에 기여할 수 있는 근본적인 요인을 식별하며, 비상장기업에 대한 잠재적인 감시 또는 보고 격차를 평가하는 것이 필요하다.
|
시사점 |
* 본 컬럼은 의료기기를 비롯한 헬스케어 분야의 국내외 학회지에 발표된 논문 및 연구보고서 등을 살펴봄으로써 우리나라 의료기기 관련 보건의료정책 마련에 통찰력을 제공하기 위한 목적으로 매주 발표됨
출처 : Development and Commercialization Pathways of AI Medical Devices in the United States: Implications for Safety and Regulatory Oversight
Lee B, et al. NEJM AI. DOI: 10.1056/AIra2500061
https://ai.nejm.org/doi/full/10.1056/AIra2500061

