코로나19 위기단계 심각에서 경계로 하향 조정에 따른 조치
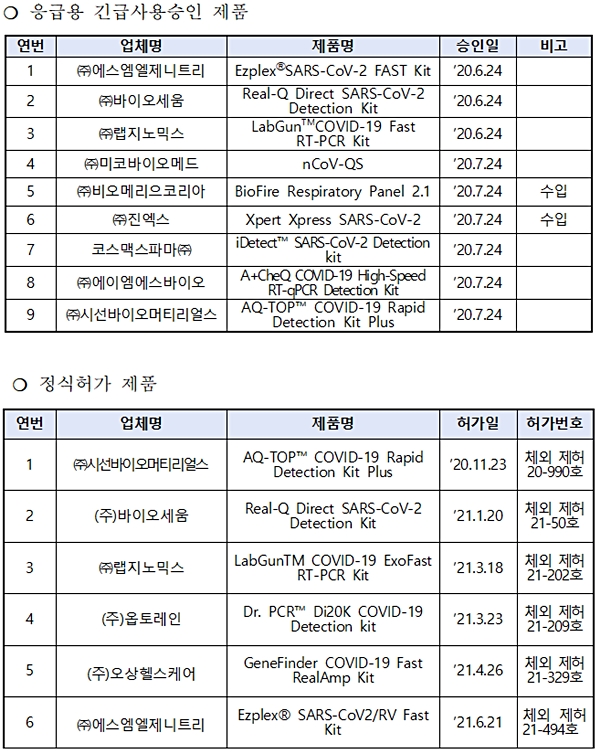
식품의약품안전처(처장 오유경)는 2020년 코로나19 발생 초기 응급환자에 대한 코로나19 검사 소요 시간 1시간 이내로 단축을 위해 '긴급사용승인'한 '코로나19 응급용 유전자진단시약' 9개 제품의 긴급사용을 지난 1일 자로 종료하며, 6월 2일부터는 정식 허가 제품만 코로나19 검사에 사용할 것을 당부했다고 지난 1일 밝혔다.

다만 의료기관에서 기존 제품의 재고를 소진하고, 다른 제품에 대한 도입을 준비하며 의료기관의 검사 역량과 정확도를 유지하기 위해 3개월의 유예기한을 둔다.
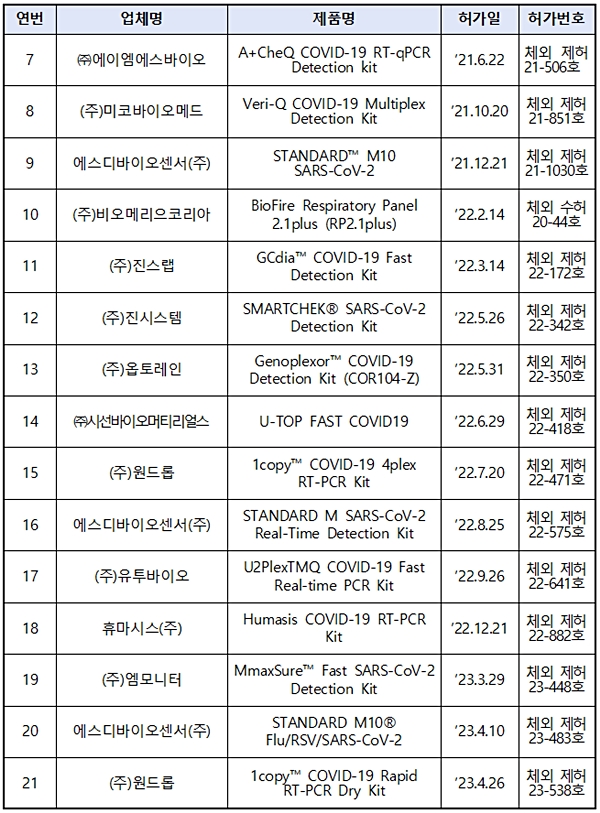
이번 조치는 '코로나19 위기단계 하향(심각→경계) 조정 및 방역 조치 전환'(6.1.)을 대비해 △9개 제품 업체 간담회 △사용기관과 업무협의 △허가현황 △생산량·공급량·재고량 등을 종합적으로 고려한 결과, 정식허가된 응급용 21개 제품이 긴급사용승인 제품을 충분히 대체할 수 있다는 판단에 따른 것이다.
식약처는 "앞으로도 체외진단의료기기 업계와 질병관리청 등 유관기관과 긴밀한 협조를 유지해 공중보건 위기 상황 시 신속하게 대응할 수 있도록 최선을 다하고 국민 안전을 지키는 기관의 역할을 충실히 수행하겠다"라고 밝혔다.
오민경 기자
webmaster@kmdia.or.kr

