임상자료 심사 대상 판단기준 등 심사에 필요한 자료 명확화
식약처(처장 오유경)는 창상피복재의 기술문서 작성 방법을 안내하고 심사에 필요한 자료 요건을 명확히 하여 창상피복재 개발을 지원하기 위해 지난 6일 기존 가이드라인 8종(붙임1)을 통합·현행화한 ‘창상피복재 허가·인증·심사 통합 가이드라인’을 발간·배포했다고 지난 7일 밝혔다.

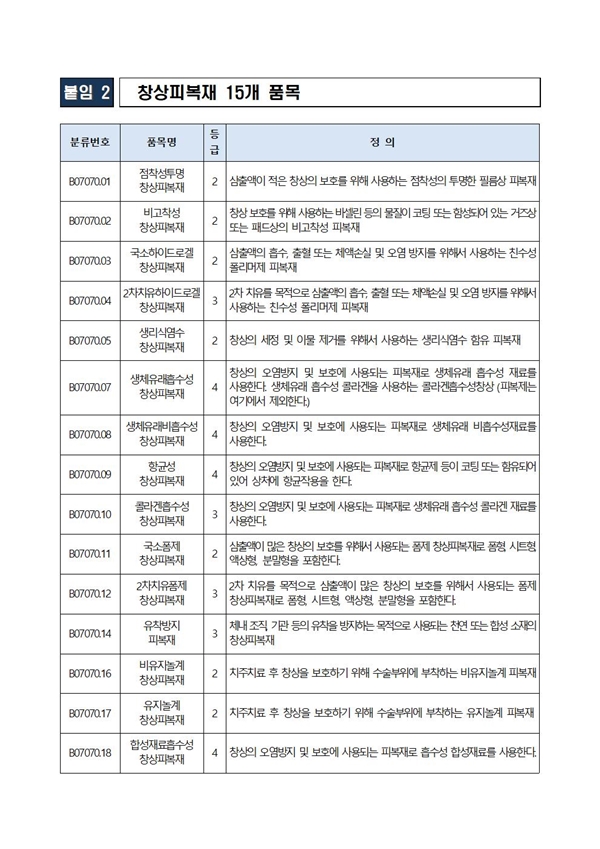
가이드라인의 주요 내용은 △창상피복재 분류와 정의 △등급별 기술문서 심사·허가·인증 절차 △품목별 기술문서 작성 방법 예시 △심사에 필요한 자료 요건 △임상자료 심사 대상 판단기준 △자주하는 질의·답변 등이다.
특히 이번 가이드라인에서는 사용목적, 원재료, 사용방법 등에 따라 임상시험에 관한 자료 제출이 필요한 경우에 대하여 상세하게 예시를 들어 설명했다.
식약처는 이번 가이드라인이 업체의 창상피복재 제품개발과 신속한 인허가에 도움을 줄 것으로 기대하며, 앞으로도 과학적 지식과 규제과학 전문성을 기반으로 안전하고 효과 있는 의료기기가 제품화될 수 있도록 최선을 다해 지원하겠다고 말했다.
자세한 내용은 식약처 대표 누리집(mfds.go.kr)→법령/자료→법령정보→민원인안내서에서 확인할 수 있다.

박민진 기자
webmaster@kmdia.or.kr

