이상수의 health policy insight
[Health Policy Insight 397호]
미국 보험청(Centers for Medicare & Medicaid Services, CMS)은 혁신을 촉진하는 동시에 메디케어 가입자가 건강 결과(health outcomes)를 개선할 신기술에 보다 빠르고 일관성 있게 접근할 수 있도록 하는데 전념하고 있다. 이 약속의 일환으로 CMS는 ‘신기술의 과도기적 보험급여(Transitional Coverage for Emerging Technologies, TCET)’ 경로를 발표했다.

메드트로닉 코리아 전무
오늘 발표에는 보험급여 검토(coverage reviews) 및 근거개발(evidence development)에 대한 CMS의 접근방식에 실질적인 변화를 제안하는 제안된 절차통지와 몇 가지 제안된 지침문서가 포함되어 있다. 제안된 절차통지는 새로운 신속 메디케어 보험급여 경로를 설명한다. 자발적이고 FDA가 지정한 혁신 의료기기(Breakthrough Devices)에 적용되는 TCET 경로는 메디케어 인구를 위한 강건한 보호장치를 개발하는 동시에, 효율적이고 예측 가능하며 투명한 보험급여 검토 프로세스를 제공하여 혁신을 지원한다. 새로운 경로는 제조업체에게 CMS와의 시판 전 업무 기회를 늘리고, 보험급여에 대한 근거 격차를 해결할 수 있는 새롭고 전례 없는 수준의 유연성을 제공한다.
TCET 경로의 목표는 환자와 의사가 헬스케어 의사결정을 내리고 메디케어 가입자가 양질의 케어를 받을 수 있도록 신뢰할 수 있는 근거를 개발하는 것이다. TCET 경로는 ‘전국보험급여 의사결정(national coverage determination, NCD)’ 및 ‘근거 창출을 통한 보험급여(coverage with evidence development, CED)’ 프로세스를 이용하여 특정 혁신 의료기기의 메디케어 보험급여를 촉진한다. TCET는 중요한 근거 격차를 식별하면서, 기술의 잠재적 유해(harms)와 혜택(benefits)에 대한 시판전 평가를 통해 보험급여 옵션에 대한 불확실성을 줄이는 것을 목표로 한다. 또한, TCET 경로는 급여 범주 결정(benefit category determination), 코딩(coding) 및 지불보상(payment) 검토를 조정하는데 도움이 된다. 마지막으로 TCET를 통해 제조업체는 ‘목적에 부합하는(fit-for-purpose)’ 연구를 통해 근거 격차를 해결할 수 있다. 목적에 부합하는 연구는 연구 설계, 분석 계획 및 연구 데이터가 연구가 답하고자 하는 질문에 적합한 연구를 의미한다. CMS는 목적에 부합하는 연구 설계가 제조업체에게 더 편리할 것이라고 믿고 있는데, 이러한 연구 중 다수는 케어 제공을 통해 이미 수집된 데이터를 사용할 수 있기 때문이다. TCET은 다음 기능을 통합한다:
ㆍ TCET는 메디케어 급여 범주(benefit category)에 속하는 FDA가 지정한 혁신 의료기기(Breakthrough Devices)에 적용된다.
ㆍ 제조업체의 TCET 경로 참여는 자발적이다.
ㆍ CMS는 FDA가 의료기기에 대한 시판승인을 결정하기 전에 초기 ‘근거 미리보기(Evidence Preview)’를 수행하고 근거 강도에 따라 제조업체와 최상의 이용가능한 보험급여 경로(coverage pathways)를 논의한다.
ㆍ FDA 시판승인 전에, CMS는 보험급여 목적과 이를 해결할 수 있는 연구 설계 유형에 대한 근거 격차에 대해 제조업체와 논의를 시작한다. 그런 다음 제조업체는 근거개발계획(evidence development plan, EDP)을 제안한다. EDP 개발 프로세스의 일환으로, CMS는 제조업체와 협력하여 CMS 근거 개발 및 FDA 시판 후 요건을 모두 효율적으로 충족시킨다.
ㆍ TCET 경로에 있는 혁신 의료기기의 경우, CMS 목표는 FDA 시판승인 후 6개월 이내에 TCET NCD를 완료하는 것이다. CMS는 TCET NCD에 따른 보험급여를 환자와 의사의 의사결정에 알리고 예측가능한 장기간 메디케어 보험급여 결정으로 이어질 수 있는 근거의 시기적절한 생성을 촉진하는데 필요한 기간 동안만 지속할 계획이다.
TCET 경로와 새로운 근거 개발 프레임워크(evidence development framework)를 개발할 때, CMS는 환자그룹, 의료전문가, 의료기기 제조업체, 혁신가 및 기타 연방기관으로부터 광범위한 피드백을 요청했다. 이 피드백에는 실사용 데이터(real-world data, RWD)를 2차적으로 사용하는 것을 포함하여, CMS가 목적에 부합하는 연구 설계를 고려하는 보다 민첩하고 반복적인 근거 검토 프로세스를 사용하도록 요청한 사항이 포함되었다. CMS는 ‘Agency for Healthcare Research and Quality (AHRQ)’와 협력하여 제안된 CED 패러다임에 더 큰 유연성을 통합하고 목적에 부합하는 연구 설계를 허용하는 포괄적인 접근방식을 개발했다. CMS는 메디케어가 메디케어 가입자의 건강에 필수적인 보호 및 엄격한 근거기준을 유지하면서 신의료기술에 대한 접근성을 촉진하도록 이해관계자와 계속 협력할 것이다.
TCET 절차통지 외에도, CMS는 2022년 11월 AHRQ 보고서 및 2023년 2월 ‘메디케어 근거개발 및 보험급여자문위원회(Medicare Evidence Development & Coverage Advisory Committee, MEDCAC)’를 기반으로 업데이트된 ‘근거 창출을 통한 보험급여(Coverage with Evidence Development, CED)’ 지침문서에서 새로이 제안된 기준과 ‘전국 보험급여 분석 근거 검토(National Coverage Analysis Evidence Review)’ 지침을 발표하여 목적에 부합하는 연구설계를 좀더 명확하게 허용했다. 대중은 60일간 TCET 절차통지와 제안된 CED 및 근거검토(Evidence Review) 지침문서에 대한 의견을 제공할 수 있다. 또한, CMS는 우선순위 치료 영역(priority therapeutic areas) 내에서 건강 결과와 임상적으로 의미 있는 차이를 검토하는 일련의 지침문서 중 첫 번째 문서를 발표했다. 대중은 또한 60일간 이 지침문서에 대한 의견을 제시할 수 있다. 또한, CMS는 올해 후반에 보다 자세한 목적에 부합하는 지침을 게시할 예정이며, 대중은 이 문서에 대한 의견을 제공할 기회를 갖게 된다. 마지막으로 CMS는 곧 TCET 절차통지 및 지침문서에 요약된 새로운 근거개발 프레임워크의 측면을 통합할 NCD 시범사업의 시작을 발표할 예정이다.
TCET 경로(TCET Pathway)
TCET 경로는 보험급여 결정을 내릴 때 다음과 같은 여러 고려사항의 균형을 맞추기 위한 것이다: (1) 신기술에 대한 조기의, 예측 가능하고, 안전한 가입자 접근성을 도모하고, (2) 기술의 잠재적 혜택과 유해를 조기에 평가하여 보험급여에 대한 제조업체와 혁신가의 불확실성을 줄이고, (3) 근거 격차가 존재하는 경우, 근거 개발을 장려한다.
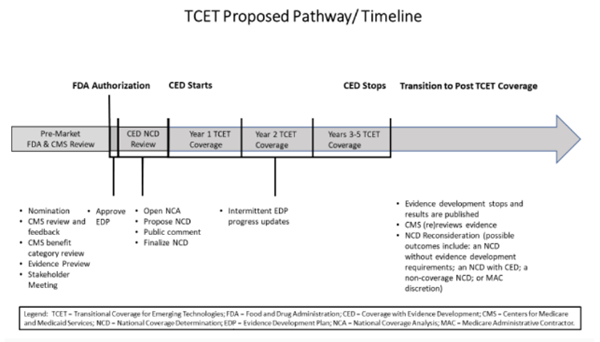
TCET에 따른 근거 개발(Evidence Development Under TCET)
신기술에 대한 새로운 보험급여 경로는 메디케어 가입자가 건강 결과를 개선할 신기술에 접근할 수 있도록 근거 격차가 존재할 때 근거 개발을 촉진하는 것이 중요하다. 근거 격차가 존재하는 경우, CMS는 제조업체와 긴밀히 협력하여 TCET 경로에서 보험급여를 용이하게 하는 근거 개발을 위해 최선을 다하고 있다. 특히, CMS는 제조업체와 협력하여 TCET 경로에 따른 근거 개발이 의료기기에 대한 FDA 시판 후 요건과 중복되거나 충돌하는 근거 개발을 요구하지 않도록 한다. TCET 경로를 통해 메디케어 보험급여를 지원하기 위한 근거 개발은 보다 투명하고 예측 가능한 근거 생성 프레임워크(evidence-generation framework)를 기반으로 한다. TCET 절차 통지 외에도, CMS는 2022년 11월 AHRQ 보고서 [https://effectivehealthcare.ahrq.gov/products/coverage-evidence-development/research-report] 및 2023년 2월 MEDCAC [https://www.cms.gov/medicare-coverage-database/view/medcac-meeting.aspx?medcacid=79]를 기반으로 업데이트된 CED 지침문서에서 새로 제안된 기준을 발표했고, 목적에 부합하는 연구 설계를 좀 더 명확하게 하기 위한 ‘전국 보험급여 분석 근거 검토(National Coverage Analysis Evidence Review)’ 지침을 발표하였다. CMS는 올해 말에 보다 자세한 목적에 부합하는 지침을 게시할 예정이다. 또한, CMS는 우선순위 치료 영역(priority therapeutic areas)에서 건강 결과와 임상적으로 의미 있는 차이를 검토하는 일련의 지침문서 중 첫 번째 문서를 발표했다. 대중은 이러한 지침문서에 대한 의견을 제공할 수 있다. CMS의 지침문서는 https://www.cms.gov/medicare-coverage-database/reports/national-coverage-medicare-coverage-documents-report.aspx?docTypeId=1#에서 찾아볼 수 있다. 마지막으로 CMS는 곧 TCET 절차통지 및 지침문서에 기술된 새로운 근거 개발 프레임워크(evidence development framework) 측면을 통합할 NCD 시범사업 시작을 발표할 예정이다. 근거 개발을 촉진하기 위한 TCET 경로의 주요 구성요소는 다음과 같다:
특정 항목 또는 서비스에 대한 근거 격차를 포함하여 이용가능한 근거의 강점과 약점에 대한 초기 피드백을 제공하는 집중적인 문헌검토인 근거 미리보기(Evidence Preview): CMS 및 제조업체의 판단에 항목 또는 서비스에 대한 최상의 이용가능한 보험급여 옵션에 대해 알리고, 근거 상태 및 주목할 만한 근거 격차에 대해 제조업체 및 CMS에 더 큰 효율, 예측 가능성 및 투명성을 제공하기 위해 마련되었다. CMS는 2020년에 AHRQ와 공동으로 처음 개발된 프로토콜에 따라 표준화된 근거 등급(standardized evidence grading), 편향 위험평가(risk of bias assessment) 및 적용가능성 평가(applicability assessment)를 이용하여 계약자가 근거 미리보기(Evidence Previews)를 수행할 계획이며, 제안된 근거 검토(Evidence Review) 지침문서에 반영된다. ‘근거 미리보기(Evidence Preview)’는 NCD 개시를 알리는 추적 시트(tracking sheet)가 게시될 때 CMS 웹사이트에서 공개적으로 제공된다.
'근거 미리보기'에서 확인된 근거 격차를 해결하기 위해 제조업체가 개발할 ‘근거 개발 계획(Evidence Development Plan, EDP): 연구 설계는 적용가능한 모든 CMS 지침문서를 따르는 경우, EDP에는 전통적인 임상연구 설계 및/또는 실사용 데이터(real-world data, RWD)의 2차 사용에 의존하는 연구 설계를 포함하여 목적에 부합하는 연구 설계가 포함된다. EDP 개발에는 CMS-AHRQ 협력이 포함되어 EDP가 과학적 무결성(integrity) 및 메디케어 인구와의 관련성에 대한 확립된 기준을 충족하는지 확인하기 위해 EDP를 평가한다. 또한, 제조업체와의 CMS 참여를 통해 피드백을 제공하고 권고된 개선사항을 논의한다. EDP의 요소, 특히 비전매특허 정보(non-proprietary information)는 제안된 NCD가 게시될 때 CMS 웹사이트에서 공개적으로 제공된다.
의료기기 적격성(Device Eligibility)
획기성 지정(Breakthrough designation) 상태에 대한 고유한 FDA 기준을 고려할 때, TCET 경로는 TCET와 같은 경로에 대한 가장 즉각적인 필요가 있는 영역이기 때문에 적격한 FDA가 지정한 혁신 의료기기에 적용된다. TCET 경로에 대한 적절한 후보에는 다음과 같은 의료기기가 포함된다:
ㆍ FDA가 지정한 특정 혁신 의료기기
ㆍ 메디케어 급여 범주(benefit category)에 해당하는 경우
ㆍ 이미 기존 메디케어 NCD의 대상이 아닌 경우
ㆍ 법률이나 규정을 통해 보험급여에서 달리 제외되지 않은 경우
연방 식품 의약품 화장품법(Federal Food, Drug, and Cosmetic Act (21 U.S.C. 321(h)(1)) 섹션 201(h)(1)에서 의료기기 정의에 따라 진단 실험실 검사(diagnostic laboratory tests)가 포함된다. 진단 실험실 검사는 보험급여 정책 개발의 매우 구체적인 영역이며, CMS는 역사적으로 이러한 검사 중 많은 부분에 대한 검토를 전문적인 메디케어 관리 계약자(Medicare Administrative Contractors, MACs)에게 위임했다. CMS는 혁신성 지정 상태가 부여된 진단검사에 대한 대부분의 보험급여 의사결정이 기존 경로를 통해 MACs에 의해 계속 결정되어야 한다고 믿는다.
TCET 경로 후보(Nominations for the TCET Pathway)
FDA가 지정한 혁신 의료기기의 제조업체는 자발적으로 TCET 경로에 참여하도록 자가지명(self-nomination)할 수 있다. TCET 경로에 관심이 있는 경우, 제조업체는 이 목적을 위해 특별히 설정된 이메일 상자를 통해 TCET에 대한 관심을 CMS에 알리기만 하면 된다. 제조업체가 CMS에 TCET 경로 지명을 제출하는 적절한 기간은 제조업체가 결정한 제출에 대한 FDA의 예상 결정이 있기 약 12개월 전이다. 통지에는 제조업체가 자가 지명 서류에 포함해야 하는 정보가 요약되어 있다. 후보 지명에 대한 CMS의 고려사항에는 제조업체와의 회의가 포함되어 기술에 대해 논의하고 프로세스에 대한 모든 질문에 답변한다. CMS는 FDA와 만나 기술에 대한 자세한 정보를 얻고, 의료기기 및 잠재적인 검토 시점에 대한 예비 정보를 받는다. 지명 고려 과정의 일부로, 기술은 급여 범주 검토(benefit category review)를 거친다. CMS의 지명 검토가 완료되면, CMS는 제품이 TCET 경로에 적합한 후보인지 여부를 이메일로 제조업체에 알린다.
TCET 경로 후보(Nominations for the TCET Pathway)
FDA가 지정한 혁신 의료기기의 제조업체는 자발적으로 TCET 경로에 참여하도록 자가지명(self-nomination)할 수 있다. TCET 경로에 관심이 있는 경우, 제조업체는 이 목적을 위해 특별히 설정된 이메일 상자를 통해 TCET에 대한 관심을 CMS에 알리기만 하면 된다. 제조업체가 CMS에 TCET 경로 지명을 제출하는 적절한 기간은 제조업체가 결정한 제출에 대한 FDA의 예상 결정이 있기 약 12개월 전이다. 통지에는 제조업체가 자가 지명 서류에 포함해야 하는 정보가 요약되어 있다. 후보 지명에 대한 CMS의 고려사항에는 제조업체와의 회의가 포함되어 기술에 대해 논의하고 프로세스에 대한 모든 질문에 답변한다. CMS는 FDA와 만나 기술에 대한 자세한 정보를 얻고, 의료기기 및 잠재적인 검토 시점에 대한 예비 정보를 받는다. 지명 고려 과정의 일부로, 기술은 급여 범주 검토(benefit category review)를 거친다. CMS의 지명 검토가 완료되면, CMS는 제품이 TCET 경로에 적합한 후보인지 여부를 이메일로 제조업체에 알린다.
TCET 경로에 따른 보험급여 기간(Duration of Coverage Under the TCET Pathway)
TCET NCD에 따른 보험급여는 환자와 의사의 의사결정에 정보를 제공할 수 있는 근거를 적시에 생성하는데 필요한 기간 동안만 지속된다. TCET 경로를 통한 과도기적 보험급여 기간은 CMS와 AHRQ가 승인한 EDP에 연계된다. EDP에 지정된 검토 날짜는 제조업체가 분석을 완료하고, 1개 이상의 보고서 초안을 작성하고, 동료심사 저널에 게시를 위해 제출할 수 있도록 연구 완료 후 1년의 추가 보험급여를 제공한다. 일반적으로 ‘근거 미리보기’에서 확인된 근거 격차를 해결하고 예측 가능한 장기적인 메디케어 보험급여 결정으로 이어지는 근거가 생성되기 때문에 이 기간은 3~5년간 지속될 것으로 예상된다.
TCET 이후의 보험급여 전환(Transition to Post-TCET Coverage)
CMS는 EDP에 명시된 검토 날짜로부터 6개월 이내에 업데이트된 근거 검토를 수행한다. ‘근거 미리보기’에 이용된 프로세스와 유사하게, CMS는 ‘체계적 문헌고찰(systematic literature review)’을 수행하기 위해 제3자 계약자를 고용할 계획이다. 계약자는 질적 근거 합성(qualitative evidence synthesis)을 수행하고, 원래(original) NCD에 지정된 각 결과(outcome)에 대한 벤치마크(benchmark)와 해당 결과를 비교한다. CMS는 계약자 검토에 대한 품질 보증을 수행한다. CMS는 또한 적용가능한 진료 가이드라인(practice guidelines)과 합의진술서(consensus statements)를 검토하고, 보험급여 조건이 적절한지 여부를 고려한다. 이러한 평가를 기반으로 적절한 경우, CMS는 다음 결과 중 하나를 제안하는 제안된 의사결정을 게시하여 NCD 재고찰을 시작한다: (1) 근거 개발 요건이 없는 NCD; (2) 지속적인 근거 개발 요건이 있는 NCD; (3) 비급여(non-coverage) NCD; 또는 (4) NCD를 폐지하여 사회보장법 섹션 1862(a)(1)(A)에 따라 MAC이 보험급여 의사결정을 내리도록 한다. 표준 NCD 프로세스 및 일정은 계속 적용되며, 30일의 공개 의견청취 기간 후 CMS는 60일간 NCD 재고찰을 완료해야 한다.
유사 의료기기의 보험급여(Coverage of Similar Devices)
FDA가 시판승인한 혁신 의료기기는 종종 다른 제조업체가 개발한 유사 의료기기가 뒤따른다. CMS는 의사와 환자가 환자의 개별 상황에 따라 최상의 이용가능한 치료에 대한 결정을 내리는 것이 중요하다고 생각한다. CMS는 혁신 의료기기와 유사한 의료기기가 별도의 NCD 하에서 다루어져야 하는지 또는 EDP를 제안하는 요건을 포함하여 혁신 의료기기와 동일한 보험급여 조건에 따라야 하는지 여부에 대해 대중의 의견을 구하고 있다. TCET 경로에 대한 자세한 내용은 https://www.federalregister.gov/public-inspection/2023-13544/medicare-program-transitional-coverage-for-emerging-technologies를 방문하면 된다.
|
시사점 ㆍ 미국 보험청은 혁신을 촉진하는 동시에 메디케어 가입자가 건강 결과를 개선할 신기술에 보다 빠르고 일관성 있게 접근할 수 있도록 하는데 전념하고 있음. 이 약속의 일환으로 ‘신기술의 과도기적 보험급여(Transitional Coverage for Emerging Technologies, TCET)’ 경로를 발표함 ㆍ 자발적이고 FDA가 지정한 혁신 의료기기에 적용되는 TCET 경로는 메디케어 인구를 위한 강건한 보호장치를 개발하는 동시에, 효율적이고 예측 가능하며 투명한 보험급여 검토 프로세스를 제공하여 혁신을 지원함 ㆍ TCET 경로는 ‘전국보험급여 의사결정’ 및 ‘근거 창출을 통한 보험급여’ 프로세스를 이용하여 특정 혁신 의료기기의 메디케어 보험급여를 촉진함 |
출처원 : Transforming Medicare Coverage: An New Medicare Coverage Pathway for Emerging Technologies and Revamped Evidence Development Framework
Fleisher L, et al. Centers for Medicare & Medicaid Services (CMS). Jun 22, 2023
https://www.cms.gov/blog/transforming-medicare-coverage-new-medicare-coverage-pathway-emerging-technologies-and-revamped
https://www.cms.gov/newsroom/fact-sheets/notice-comment-transitional-coverage-emerging-technologies-cms-3421-nc
https://www.federalregister.gov/public-inspection/current
* 본 컬럼은 의료기기를 비롯한 헬스케어 분야의 국내외 학회지에 발표된 논문 및 연구보고서 등을 살펴봄으로써 우리나라 의료기기 관련 보건의료정책 마련에 통찰력을 제공하기 위한 목적으로 매주 발표됨

