KOTRA, 취리히무역관
취리히 무역관에서는 2021년 8월 스위스-EU 의료기기 규정 개정에 관한 기사를 발행한 바 있다.
개정된 규정은 스위스로 의료기기를 수출하는 한국 기업에 직접적인 영향을 미칠 전망인데, 개정 이후 현재까지 스위스 및 EU 내에서 세부 사항들이 재논의되었고 변경된 부분도 있어 이번 기사를 통해 변경된 규정의 핵심 내용을 정리하고 한국 기업에 필요한 정보를 간추려본다.
타임라인

의료기기, 스위스-EU 상호인정협정(MRA)에서 제외
2021년 5월 말까지만 해도 한국 의료기기 업체는 EU 수출에 필요한 규격 인증(CE)을 획득하기만 하면 스위스 시장 진입을 위한 별도 절차를 밟을 필요가 없었다. 스위스-EU 간 무역 장벽 해소를 위해 2002년 6월 1일부터 시행해온 상호인정협정(MRA, Mutual Recognition Agreement) 덕분이었다.
해당 협정의 핵심은 스위스 업체가 EU 시장에 대해 EU 회원국과 동등한 접근권을 갖고, 마찬가지로 EU 업체들도 스위스 시장 접근을 위해 별도의 스위스 규격 인증을 획득하지 않아도 된다는 것이었다. 이 상호인정협정은 기계, 의료기기, 전자제품, 건설 부품, 살 생물제 등 광범위한 품목에 적용되었다.
해당 품목을 생산하는 한국과 같은 EU 비회원국 업체들로서는 접근성도 높고 가격도 상대적으로 저렴한 EU 국가에서 인증을 받아 스위스까지 수출하는 것이 유리했다. 의료기기 생산 업체들도 마찬가지였다. 그러나 2021년 5월 26일부로 의료기기가 스위스-EU 상호인정협정에서 제외되면서 외국 업체들의 스위스 수출에 어려움이 생겼다.
EU 새 의료기기규정과 의료기기 상호인정협정 제외 배경
EU는 2017년 5월 기존 의료기기 지침(MDD, Medical Device Directives) 및 체외 진단 의료기기 지침(In-vitro Diagnostic Medical Devices Directive, IVDD)을 새로운 의료기기 규정(MDR, Medical Device Regulation) 및 체외 진단 의료기기 규정(In-vitro Diagnostic Medical Devices Regulation, IVDR)으로 개정하는 안을 통과시켰다.
의료기기 규정(MDR, IVDR)은 의료기기 지침(MDD, IVDD)에 비해 안전성, 위생, 시장 진입 이후 관리 감독 등의 면에서 더욱 엄격한 기준을 적용하기 때문에, 훨씬 광범위하고 상세한 인증 기준이 요구된다. 이와 같은 EU의 새 의료기기 규정(MDR, IVDR)에 상응하도록 스위스도 의료기기 법안을 대폭 개정했다.
자국 법 개정과 동시에 스위스-EU 상호인정협정(MRA) 의료기기 부문도 업데이트되어야 했다. 문제는 이 상호인정협정이 더 광범위한 틀인 스위스-EU 제도적 기본협정(Institutional Framework Agreement)의 적용 범위에 속한다는 것이다. 제도적 기본협정은 스위스가 EU 비회원국으로서 EU와 체결한 120개 이상의 양자 협정을 대체할 포괄적인 조약으로서 제안되었다.
포괄적인 조약이 필요했던 이유는 무엇보다도 120개 이상이나 되는 양자 협정 내용이 EU 규정 변경 때마다 수시로 업데이트되어야 하는 번거로움 때문이었다. 이에 스위스와 EU는 2014년부터 제도적 기본협정 내용을 협상하기 시작했다.
그러나 7년간 이어진 지속적인 협의에도 불구하고 양측이 임금 수준, EU 이민자에 대한 스위스 복지 제공 등에 대한 의견차를 좁히지 못함에 따라 결국 2021년 5월 26일 협상이 최종적으로 결렬되었다.
바로 이 지점에서 의료기기가 스위스-EU 상호인정협정에서 제외되었다. EU의 의료기기 규정(MDR, IVDR)이 발효되기 전까지 양측이 상호인정협정 의료기기 부문에 이 새 규정을 적용시키는데 합의하지 못한 데다가, 제도적 기본협정까지 결렬되면서 부문별 협정 역시 요원해진 것이다.
의료기기 상호인정협정 제외 결과
의료기기가 스위스-EU 상호인정협정에서 제외됨에 따라 많은 변화가 생겼다. 우선 당사자인 스위스와 EU 회원국 의료기기 제조업체들은 상대 시장에 접근하기 위해 기존에는 불필요했던 절차를 밟아야 한다. 양측은 상대 시장에 소재지를 둔 공인대리인을 지정해야 하며, 스위스 소재 인증기관에서 발급한 인증서는 EU에서 더 이상 유효하지 않게 됐다.
당사자뿐만 아니라 한국 업체를 비롯하여 스위스로 의료기기를 수출하는 제3국 소재 업체에도 절차적 변화가 생겼다. 스위스-EU 제도적 기본협정 결렬과 동시에 스위스에서 결렬에 대비해 준비했던 새 의료기기 조례(MedDO, IvDO)가 발효되었기 때문이다.
새 조례에 따르면 첫째, 모든 외국 업체들은 스위스 내 공인대리인(Swiss Authorized Representative 또는 CH-REP)을 반드시 지정하여 CHRN(The Swiss Single Registration Number, 원어: einmalige Registrierungsnummer)이라는 등록 번호를 발급받아야 한다. CHRN 등록이 필요한 이유는 상호인정협정에서 의료기기가 제외됨에 따라 스위스 의료기기 규제 기관이 EU 정보관리망에 더 이상 접근할 수 없어졌기에 자국용 시장 감시 시스템이 필요해졌기 때문이다.
둘째, 기존 의료기기 지침(MDD, IVDD)에 따라 CE 인증을 받은 제품들은 전환 기간이 경과하기 전까지 새 의료기기 규정(MDR, IVDR)에 따른 CE 인증을 받아야 한다. 이처럼 변경된 스위스 의료기기 규정의 세부 사항과 한국 기업이 유의할 점을 아래에서 상세히 살펴본다.
변경 사항 (1) 스위스 공인대리인 지정 및 CHRN 발급
스위스 공인대리인이란 스위스에 소재한 자연인 또는 법인으로, 해외 제조업체로부터 그를 대신하여 특정 업무를 수행하도록 서면으로 위임받은 자를 뜻한다. 공인대리인의 가장 중요한 업무로는 외국 제조업체의 의료기기 스위스 규정 준수 여부 확인, 스위스 규제 당국과 커뮤니케이션 및 협력, 라벨 제작 및 등록 절차 지원 등이 있다.
공인대리인은 스위스 의료기기 감독 기관인 Swissmedic이 심사해서 관리하는데, 대부분 사기업으로 전체 리스트는 별도로 공개되지 않기 때문에 포털 검색을 통해 (검색어: Swiss Authorized Representative 또는 CH-REP) 확인해야 한다.
한국과 같은 EU/EFTA 비회원국 대상 스위스 공인대리인 지정 유예 기간이 의료기기의 경우 2021년 5월 26일, 체외 진단 기기의 경우 2022년 5월 26일로 이미 만료되었기 때문에 스위스로 수출을 희망하는 한국 업체는 반드시 스위스 내 공인대리인을 지정해야 한다.
공인대리인을 지정하는 절차는 다음과 같다.
① 제조업체가 제품 설명, 기술 문서, GMDN(Global Medical Device Nomenclature) 코드, 업체 소개 및 품질경영시스템에 관한 문서를 포함하여 공인대리인에 신청
② 공인대리인이 견적서 발행
③ 제조업체- 공인대리인 간 계약 체결
④ 공인대리인이 Swissmedic에 보고
⑤ Swissmedic이 공인대리인에 CHRN 번호 발급
한편 CHRN(The Swiss Single Registration Number)은 경제 운영자(economic operator)가 스위스 의료기기 감독 기관인 Swissmedic에 등록하여 발급받는 번호로, 해당 번호를 발급받아야만 합법적으로 스위스 시장에서 의료기기 유통이 가능하다.
중요한 것은 CHRN은 유통에 관계된 운영자에게 발급되는 번호이지 특정 의료기기 제품의 등록 번호가 아니라는 점이다. 경제 운영자는 우선 CHRN을 발급받아야 하며, 이후 의료기기 제품을 신고해야 한다.
경제 운영자로는 스위스 소재 제조업체, 수입업체 또는 공인대리인 중 누구라도 등록할 수 있다. 위에서 언급했듯이 외국 업체는 스위스 내 공인대리인을 반드시 지정해야 하기 때문에 이 공인대리인이 CHRN을 발급받으면 된다. 스위스 공인대리 인명과 주소는 아래의 로고와 함께 제품에 부착되어야 한다.

공인대리인의 자격 및 역할에 관한 더욱 자세한 정보는 아래의 링크에서 확인해 볼 수 있다.
- Swissmedic 자료 "의료기기 공인대리인, 수입업체, 유통 업체의 의무" https://www.swissmedic.ch/swissmedic/en/home/medical-devices/market-access/pflichten-bevollmaechtigte.html
- Swissmedic 자료 "의료기기 관련 자주 묻는 질문" https://www.swissmedic.ch/swissmedic/en/home/medical-devices/regulation-of-medical-devices/faq.html
공인대리인 선임 기간 및 비용
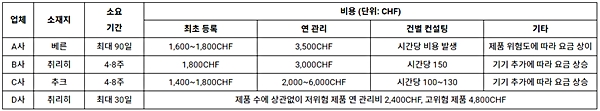
취리히 무역관에서 다수의 스위스 공인대리업체에 문의한 결과 국내 업체의 신청 시점부터 계약 체결 후 최종적으로 대행 서비스가 시작될 때까지의 소요 기간은 업체마다 차이가 있었으나 대략 4~8주다. 국내 업체가 신청서를 얼마나 정확하게 작성했는가, 양 사의 커뮤니케이션이 얼마나 원활한가에 따라 소요 기간이 달라진다.
비용의 경우 대부분의 업체가 (1) 최초 등록비 (2) 연간 관리비 (3) 특수 사례 발생 시 개별 컨설팅비 등을 청구하며 여기에 연간 책임보험료나 고급 전문 인력 투입 시 시간당 컨설팅비 등을 추가로 청구하는 업체들도 있다. 아래의 표에서 스위스 공인대리업체 4개 사의 선임 기간 및 비용을 비교해 볼 수 있다.
<스위스 공인대리업체 비교>
변경 사항 (2) CE 인증서
EU의 의료기기 지침(MDD, IVDD)이 의료기기 규정(MD, IVDR)으로 개정됨에 따라 기존 지침(Directive 93/42/EEC, Directive 90/385/EEC or Directive 98/79/EC)에 따라 발급된 CE 인증은 전환 기간 내에 새 의료기기 규정(MDR, IVDR)을 기준으로 한 CE 인증으로 대체되어야 한다. 스위스의 새 의료기기 조례도 EU가 제안한 전환 기간을 따른다.
EU는 애초 전환 기간을 2024년 5월 26일까지로 공표하고 해당일까지 만료일이 지나지 않은 기존 인증서 보유 제품이 시장에 출시되는 것을 허용했다. 그러나 EU 내 적합성 평가 기관의 업무 과중으로 인증서 발급이 신속히 진행되지 않는 데다가 다수의 제조업체가 새 의료기기 규정(MDR, IVDR)의 강화된 요구 사항을 단기간에 충족시키는 데에 어려움을 겪음에 따라 EU 시장 의료기기 공급에 차질이 예상되었다.
이에 따라 2023년 3월, EU 의회 및 이사회는 규정을 일부 수정할 것을 결정했다. 주요 수정 내용으로는 (1) 전환 기간을 2024년 5월 26일 이후로 연장, (2) 연장된 전환 기간을 기존 인증서 유효기간 연장과 통합, (3) 매도 기한 철회 등이 있다.
아직 스위스 의료기기 조례에는 해당 변경 사항이 반영되지 않았지만, 취리히 무역관이 Swissmedic에 문의한 결과 스위스 조례도 2023년 가을 EU 규정에 맞춰 변경될 예정이라 밝혔다. 의료기기 항목별로 변경된 전환 기간을 아래의 표에서 확인해 볼 수 있다.
<레거시 기기 시장 출시 및 매도 기한 변경 사항>
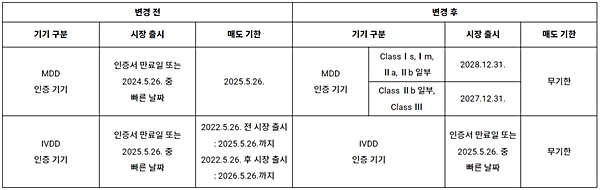
레거시 기기(legacy device)란 기존 의료기기 지침(MDD, IVDD)에 따른 인증서를 개정된 규정 발효일인 2021년 5월 26일 이전에 획득한 제품들을 뜻한다. 중요한 것은 모든 레거시 기기가 변경된 전환 기간을 적용받을 수 있는 것은 아니라는 점이다. 다음의 조건들을 모두 충족하는 경우에만 연장된 전환 기간을 적용받을 수 있다.
첫째, MDD 또는 IVDD 인증을 받은 시점으로부터 기기의 디자인이나 의도된 사용 목적에 큰 변동이 없어야 한다.
둘째, 2024년 5월 26일까지 MDR/IVDR에 부합하는 품질관리 시스템(QMS, Quality Management System)을 도입해야 한다. 품질관리 시스템에 대한 별도의 인증이 해당 단계에서는 필요하지 않다. 제조업체가 인증기관에 적합성 평가를 신청하면(다음 조항 참조) 품질관리 시스템 준수 여부도 어차피 승인 기준의 한 부문으로 평가받게 되기 때문이다.
셋째, 제조업체가 새 의료기기 규정(MDR/IVDR)에 의거한 적합성 평가를 늦어도 2024년 5월 26일까지 공인인증기관에 신청해야 하고, 2024년 9월 26일까지 인증기관과 제조업체가 이에 대한 서면 계약을 체결해야 한다. 인증 절차는 국내에 진출한 유럽 인증기관 또는 유럽 내 인증기관을 통해 진행할 수 있다.
레거시 기기의 시장 출시 기한 변경 관련하여 특히 눈에 띄는 점은 의료기기의 시장 출시 기한이 제품 위험도에 따라 차등적으로 변경됐다는 것이다. 상세한 의료기기 클래스 구분은 아래의 표에서 확인해 볼 수 있다.
<의료기기 클래스 구분>
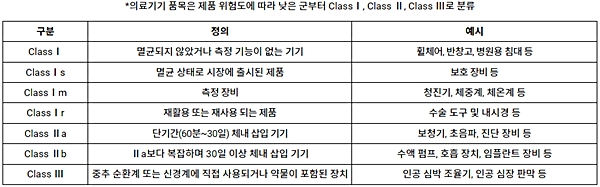
스위스로 수출을 희망하는 의료기기 제조업체는 위 표에 제시된 분류에 따라 기기의 클래스를 구분하고, 해당 기기별로 인증 유효기간에 주의할 필요가 있다.
또한 연장된 전환 기간을 적용받으려면 새 규정(MDR/IVDR)에 따른 적합성 평가에 대한 인증기관과의 서면 계약이 2024년 9월 26일까지 체결되어야 한다고 안내되어 있기는 하지만, 현재 인증기관의 업무 과다로 인한 다소 늦은 발급 속도를 고려했을 때 최대한 빠르게 인증 절차를 시작하는 것이 좋다.
유럽위원회가 최근 발간한 보고서에 따르면 실제로 2022년 10월 기준 EU 내 총 36개 MDR 인증 가능 공인인증기관이 접수한 MDR 인증 신청 총 8,120건 중 1,990건 만이 처리되었다.
국내 의료기기 업체 스위스 유통 인증 획득 지원 안내
위에서 알아본 바와 같이 EU 및 스위스 의료기기 규정 변경으로 인하여 우리나라를 포함한 제3국 기업의 스위스 의료기기 시장 진출 절차가 복잡해졌다. KOTRA 취리히무역관에서는 이런 애로 사항을 극복하기 위해 2023년 우리 기업의 스위스 의료기기 인증 획득을 연중 지원한다.
기존 의료기기 지침(MDD, IVDD)에 따른 CE 인증을 보유하고 있으나 규정 개정으로 인하여 수출에 어려움을 겪고 있는 업체들은 동 기사에서 소개된 스위스 공인대리인 지정에 필요한 대략적인 비용과 소요 기간을 확인하고, 리스트 중 특정 공인대리업체 또는 비교를 위한 여러 업체 접촉을 희망하는 경우, 취리히무역관(ktc5@kotra.ch)으로 연락 시 연결이 가능하다.
아직까지 CE 인증을 받지 않은 업체들은 인증 획득이 선행되어야 스위스 공인대리인 선임이 가능하므로 우선 인증 절차를 밟아야 한다.
자료: Swissmedic, Swiss medtech, 유럽위원회, Johner Institut, DeviceMed, Epmodex, KOTRA 취리히 무역관 자료 종합
△ 원문 보러가기 : KOTRA → 뉴스 → 전체

