KMDIA BlueSky - 회원사를 위해 노력하는 협회


| ▶ 정책기획부 - 기획팀, 교육연구팀 |
■[보험위원회] 공급위기 대응 TF 회의(08.01)
○ 주요내용 : 의료기기 공급 제반 비용의 급격한 상승에 따른 대응 계획 논의
■[심평원] 2022년 제9차 치료재료전문평가위원회 서면결의(08.03~9)
○ 주요내용 : 결정 및 조정신청 치료재료의 요양급여대상여부 및 상한금액 심의
■[식약처] 의료기기 GMP 관련 의료기기관리과 간담회 자료 공유(08.01, 02)
○ 주요내용
- 의료기기 GMP 품목군 확대 : 현재 64개 품목군 재분류에 대해 높은 등급 품목에 집중하는 전략에 부합한지 재검토 요청
- 의료기기 GMP 서류검토 부실 : 의료기기 적합성 인정 등 심사표 요구사항을 확인할 수 있는 자료 요청에 대하여 제출자료 준비 어려움 건의
- GMP 현장조사 심사일수 기준설정 부적정 : 의약품등 타분야 및 국제기준보다 제한된 심사일수로 인해 면밀한 심사가 불가함에 따라 합리적 심사일수 산정방안 지속 논의 예정
■ [감사원] 건강보험재정관리 실태 감사 결과 공유(08.02)
○ 주요내용 : 건강보험 재정지출 및 수입 구조를 결정하는 ‘재정관리체계’와 ‘지출 및 수입 관리 시스템’ 재정누수 요인 점검
- 건강보험 지출규모가 최근 10년간 2.1배 급격하게 증가하여 건강보험 재정의 건전성 우려 제기
- 건강보험 재정관리에 대한 외부통제 강화 필요
- 재정전망 추계의 정확도 개선 및 공개 확대 필요
- 건강보험 지불제도 개편 필요
- 급여적용 확대에 따른 의료계 손실보상 과다 및 급여화 항목의 심사 부실 등 관리 업무 개선 필요 등
■ [식약처] 의료기기 갱신 평가자료 인정방안 협의체 명단 제출(08.02)
○ 주요내용 : 의료기기 갱신 전면 재검토에 따른 신규 협의체 구성
- 전기(제조2, 수입2), 용품(수입4), 체진(수입1), 협회1 : 9명
■ [식약처] 「의료기기 품질책임자 교육실시기관 지정 및 교육에 관한 규정」 제정고시(안) 행정예고 의견조회(08.02)
○ 주요내용 : 「의료기기법 시행규칙」에서 위임한 의료기기 품질책임자 교육 및 교육실시기관 지정‧준수사항 등에 대한 세부사항 규정
- 품질책임자 교육 내용을 직무범위에 관한 사항, 유해물질 관리에 관한 사항 및 최신 의료기기법령 개정 사항 등으로 구체화
- 교육실시기관 지정 요건 및 절차, 교육실시기관의 교육 업무 처리 세부 내용 등
■ [진흥원] 체외진단의료기기 기업 유럽 IVDR 관련 애로사항 의견제출(08.02)
○ 주요내용 : 진흥원에서 유럽 체외진단의료기기 규제 강화에 따라 국내 체외진단의료기기 기업이 처한 사항 파악을 위해 요청한 의견조회 결과(1건) 제출
- 주요 애로사항 : NB 기관 부족에 의한 심사 일정 지연, 국내 임상시험기관 중 IVDR에서 요구하는 ISO 20916에 적합한 인증기관 없음, 기존 인력으로 IVDR 대응 어려움, IVDR 관련 교육 부족
- 정부 지원 요청사항 : IVDR 컨설팅 및 IVDR 전반에 대한 인허가 외 사업부별 세분화된 교육, 해외 임상시험 기관과의 네트워크 구축
■ [식약처] 「의료기기 허가‧신고‧심사 등에 관한 규정」 일부개정고시 안내(08.02)
○ 주요내용 : 의료기기 소프트웨어 사용과정에서 결함·오류가 지속 유지·보수되는 등 업데이트가 매우 빈번하게 발생함에 따라, 사용자 안전성과 민원인의 행정 부담을 고려하여 의료기기 소프트웨어 변경 제도를 네거티브 규제시스템으로 전환
- ‘의료기기 소프트웨어’, ‘내장형 소프트웨어’, ‘독립형 소프트웨어’, ‘모바일 의료용 앱’ 등 용어 정의 신설
- 사용목적 관련 주요기능, 분석알고리즘(분석방법), 개발언어‧운영환경 또는 통신기능의 변경 등 소프트웨어 업그레이드에 해당하는 변경사항에 대해서는 변경허가‧인증을 받거나 변경신고 하도록 하고, 그 밖의 변경사항은 해당 허가증 뒷면에 변경내용 및 일자를 직접 기재하고 식약처장에게 사후보고(30일 또는 연차)하도록 조치
■ [하랑V&S] 식약처 ‘체외진단의료기기 안전관리체계 선진화 조사 연구용역 관련 업계 간담회’ 참석 요청 및 참석자 추천(08.02)
○ 주요내용 : 식약처(혁신진단기기정책과)에서 현행 체외진단의료기기 안전관리체계 전반에 대한 평가와 변화된 환경에 부합하는 제도개선 방안 도출을 목표로 진행하는 체외진단의료기기 안전관리체계 선진화 조사 연구용역과 관련하여, 산업계 의견수렴을 위해 월 1회 정기 간담회 개최 예정에 따라 참석 요청 및 참석자 명단 제출
- 참석자 : IVD위원회 황선빈 총무간사, 한승미 사후관리‧GMP 분과장, 협회 최영미 부장
■ [식약처] 의료기기 제조허가등 갱신 관련 업계 애로사항 및 건의사항 재조회(08.03)
○ 주요내용 : 의료기기 안전성‧유효성의 주기적 재검토의 목적으로 도입된 의료기기 제조허가등 갱신 제도와 관련하여, 제도 전반에 대한 업계 애로사항 및 건의사항 의견조회
■ [식약처] 코로나19 관련 의료기기 GMP 심사 처리 절차 개선 알림(08.03)
○ 주요내용 : 코로나19 발생으로 의료기기 GMP 심사방법 전환(현장조사 → 서류검토) 과정에서 관련 근거 마련을 위한 추가 행정처리(서류검토 전환 공문 요청, 시스템 변경 등 전환을 위한 대기 등)가 발생함에 따라, 신청시점에 서류검토 가능여부를 확인하도록 의료기기 GMP 심사 전환 절차 개선방안 마련
- 산업계에 미치는 영향을 고려하여 즉시 시행
■ [식약처] `22년 제3차 의료기기 ‘소유’ 회의 결과 안내(08.04)
○ 주요내용 : 한국의료기기공업협동조합 주관으로 `22.07.15(금) 개최된 `22년 제3차 의료기기 ‘소유’ 회의 결과 안내
- ISO 10993과 일치한 EN ISO 10993 규격에 따른 시험성적서 인정 요청
- ISO 규격과 내용이 일치한 다른 EN ISO 규격까지 내부 검토 중으로, 일치한 것으로 판단된다면 해당 시험성적서 인정 및 관련 가이드라인 개정 예정
- 체외진단의료기기 업체 수에 비해 기술문서 심사기관이 현저히 부족, 추가 심사기관 확충 요청
- 체외진단의료기기 심사원 부족, 심사자격코드 부여 등 애로사항에 대해 해결방안 모색 중
- 2등급 인증 신청 시 첨부자료가 미비한 경우 접수 취소가 아닌 자료 보완 처리 요청
■ [식약처] 「의료제품 사전 검토 운영에 관한 규정」 일부개정고시(안) 의견조회(08.05)
○ 주요내용 : 의료기기 신속 제품화를 위한 사전검토 대상 확대
- 기존 신개발의료기기, 희소의료기기 외 임상시험용 의료기기(임상시험 자료 제출이 필요한 의료기기 포함) 및 혁신의료기기 등으로 확대
■ 의료기기 갱신제도 관련 의료기기 업계 제안서 제출(08.05)
○ 주요내용
- 최신기준규격 부합자료 제출을 위한 평가보고서 발행 비용 부담 및 평가보고서 발행기관의 Capacity 부족
- 최신기준규격대비 비교자료 삭제를 위한 시행규칙 및 고시개정 요청
■ [연세대학교 약학대학] 제7기 연세 제약산업 Market Access 전문가 과정 홍보(08.05)
○ 주요내용 : 의약품의 비용-효과분석, 보험등재, 약가 협상 등 의약품의 시장진입을 위해 필요한 실무지식과 방법론 습득이 필요한 자를 양성하기 위한 전문가 과정 모집
■ [보험위원회] 8월 보험위원회 특별강연 안내(08.05)
○ 주요내용 : 비급여 진료비 구성과 현황
| ▶ 대외협력부 - 홍보팀, 국제교류TF팀(IMDRF 지원사무국) |
■ [국회-보건복지위원회] 백종헌 의원실 방문(08.04)
○ 주요 내용 : ‘의료기기의날’ 국가기념일 지정 ‘의료기기법개정안’ 발의 감사 및 혁신의료기기 및 미용의료기기 분야 산업발전 논의
■ [국회-보건복지위원회] 최종윤 의원실 방문(08.04)
○ 주요 내용 : 고령화 및 저출산 대응 건강검진 확대 방안 논의
■ [한국로봇산업협회] 유럽 개정 의료기기법(MDR) 표준 대응 및 이해 교육 안내(08.03)
○ 주요내용 : 유럽 개정 의료기기법(MDR) 표준 대응 및 이해 교육 진행
■ [이씨플라자] 수출 플랫폼 구축 관련 실무회의(08.05)
○ 주요 내용 : 수출 플랫폼 구축 기능 수정사항 상세 협의 등
■ [협회] 2022 미국 시카고 방사선 의료기기 전시회 한국관 협력업체(여행사) 모집안내(08.02)
■ [협회] 2022 남아공 요하네스버그 의료기기 전시회 (Africa Health 2022) 한국관 협력업체(여행사) 모집안내(08.02)
■ [협회] 2022 일본 도쿄 의료기기 전시회 한국관 부스 디자인 설치공사 입찰공고(08.02)
■ [KOTRA] 2022년도 세계 일류상품 및 선정계획 공고 안내(08.02, 05)
○ 주요 내용 : 수출 품목의 다양화 및 고급화, 미래 성장동력 확보를 위한 2022년도 세계 일류상품 및 선정 관련 신청 접수 안내
■ [한국디지털컨버전스협회] 2022년 베트남 호치민 디지털헬스케어 지역특화 수출컨소시엄 참가기업 모집공고(08.04)
○ 주요 내용 : 서울지역 관내 디지털헬스케어 품목 중소기업의 베트남 시장진출을 위한 수출상담회 개최
| ▶ 회원지원부 - 회원지원팀, 공정경쟁관리팀 |
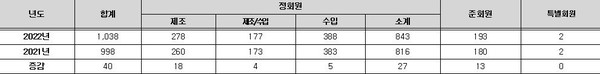
■ 회원현황
■ [KMDIA] 의료기기 배상책임보험 관련 미팅(08.02, 12, 16)
■ [윤리위원회] 8월 전체회의(08.03)
○ 주요안건 : 국내개최 국제 학술대회 진행 시 사업자의 물품 지원/기부행위 관련
■ [서울의료봉사재단] 자선기부활동 관련 논의(08.04)
○ 주요내용 : 2022년 자선기부활동 관련 논의
■ [규약심의위원회] 제08차 공정경쟁규약 심의위원회(08.12)
○ 주요내용 : 기부, 학술대회 개최·운영지원, 학술대회 참가지원, 자사제품 설명회 및 교육훈련 심의, 사전·사후 신고사항 등 심의
■ [복지부] 학술대회 내 의료기기 현물지원 관련 유권 해석 회신 안내(08.18)
○ 주요내용 : 학술대회 개최·운영 지원 시 금전 이외에 의료기기 지원가능 여부
■ [유통구조위원회] 제17차 전체회의(08.23)
○ 주요안건 : 유통구조 선진화 의료기기법 개정안 입법발의를 위한 개정법률안 검토
■ [공정거래위원회] 의료기기 업종 표준대리점거래계약서 관련 의견제출(08.25)
○ 주요내용 : 적용대상을 대리점 → 공급업자 및 대리점 변경 및 공급업자 및 대리점이 경제사정의 중대한 변동으로 폐업을 하는 경우 계약해지 가능 단서 조항 신설(천재지변, 국가비상사태, 감염병 유행 등)
■ [국회 고영인의원실] 간납사 실태조사 결과 관련 산업계 의견 제출(08.25)
■ [KMDIA] 2022년 KMDIA 자선골프대회 개최 회의(08.26)
| ▶ 공공사업부 - 통관관리팀, 광고관리팀 |
■ 표준통관예정보고 및 수입요건확인면제 업무처리 현황

■ [KMDIA] 의료기기광고 예비검토 기준 조정 회의(08.02, 09, 16, 23, 30)
■ [KMDIA] 제30~34차 자율심의기구 광고심의위원회(온라인 심의) 개최(08.03, 10, 17, 24, 31)
■ [KMDIA] 의료기기 광고 게재 주의 안내(08.04)
○ 주요내용 : 의료기기 광고 모니터링 결과에 따라 심의받지 않은 광고 및 심의받은 내용과 다른 내용의 광고를 게재하고 있는 업체를 대상으로 해당 광고 중지 및 심의받은 내용과 동일 광고 게재 조치 안내
■ [KMDIA] 표준통관예정보고 및 수입요건확인 면제 가이드라인 개정 회의(08.30)
○ 주요내용 : 가이드라인 최종 수정 작업 및 배포처 등 관련사항 논의
■ [관세청인재개발원] 통관단계 안전관리 교육 강의(08.30)
○ 주요 내용 : 의료기기표준통관예정보고(김민성과장), 불법 의료기기 적발사례(윤효상 과장)
■ [KMDIA] 의료기기 광고 심의정보 및 동향 소식지 배포(08.31)
○ 주요내용 : 의료기기 취급자 및 의료기기 광고 관련 관계자를 대상의 심의제도 및 기준, 금지되는 광고 범위 등에 대한 이해도 제고 및 인식 개선을 위한 정보 제공
| ▶ 산업연구부 - 미래전략연구팀, 정보분석팀 |
■ [한국과학기술기획평가원] 바이오헬스 주력산업화 정책연구과제 제2차 전문가 회의(08.03)
○ 주요내용 : 바이오헬스산업 주력산업화 수준 분석 및 주력산업 육성을 위한 정부 및 민간의 역할 등 논의
■ [혁신산업위원회] DTX 분과 상견례 및 kick off 회의(08.10)
○ 주요내용 : DTX 업계 현황 공유 및 산업 활성화 방안 논의 등
■ [진흥원] 의료기기산업 종합정보시스템 고도화사업 선정평가 회의(08.16)
■ [혁신산업위원회] DTX 관련 업무 회의(08.18)
○ 주요내용 : 식약처 세미나 및 국회토론회 관련 논의
■ [혁신산업위원회] 운영진 회의(08.18)
○ 주요내용 : 2022년도 하반기 위원회 운영 및 분과별 활동 계획 논의
■ [식약처] 신기술 의료기기 안전규제 관리기준 마련 연구 업무회의(08.29)
○ 주요내용 : 신설 및 세분화 제안 품목에 대한 의견 수렴
■ [KMDIA] 2022 싱가포르 의료기기 전시회(Medical Fair Asia) 참관(08.30~09.03)
○ 주요내용 : 전시회 참관 및 시장조사

