이상수의 health policy insight
● [Health Policy Insight 313회]
실세계 데이터(Real-World Data, RWD), US FDA 규제 의사결정을 위한 전자건강기록 및 청구데이터 평가 지침 초안

Medtronic North Asia
(Korea and Japan)
대외협력부 전무
2016년 12월 13일에 서명된 21세기 치유법(21st Century Cures Act, Cures Act)은 의료제품 개발을 가속화하고 이를 필요로 하는 환자에게 혁신을 더 빠르고 효율적으로 제공하기 위해 제정됐다. 다른 조항 가운데 치유법은 연방 식품, 의약품 및 화장품법(Federal Food, Drug, and Cosmetic Act, FD&C Act) (21 U.S.C. 355g)에 섹션 505F를 추가했다. 이 섹션에 따라, US FDA는 FD&C 법 섹션 505(c)에 따라 이미 승인된 의약품에 대한 새로운 적응증의 승인을 뒷받침하거나 시판 후 연구 요건(RWE 프로그램)을 지원하거나 충족하는데 도움을 주기 위해 실세계 근거(real-world evidence, RWE)의 잠재적 이용을 평가하는 프로그램에 대한 프레임워크(framework)를 만들었다.
US FDA는 "실세계 데이터 : 의약품 및 생물학적 제품에 대한 규제 의사결정을 뒷받침하기 위한 전자건강기록 및 의료 청구데이터 평가(Real-World Data: Assessing Electronic Health Records and Medical Claims Data to Support Regulatory Decision-Making for Drug and Biological Products)"라는 지침 초안을 발표했다. 지침 초안에는 FDA 승인 의약품 또는 생물학적 제품의 새로운 사용을 지원하거나 시판 후 연구 요건을 뒷받침하거나 만족시키기 위해 전자건강기록(electronic health records, EHRs) 또는 의료 청구 데이터를 사용하도록 제안하는 스폰서, 연구자 및 기타 이해당사자를 위한 권고사항이 포함돼 있다. 지침 초안에는 관심 있는 연구질문(research questions)에 답하는데 도움이 되도록 EHR 또는 의료 청구 데이터베이스에서 사용에 적합한 실세계 데이터를 선택하기 위한 고려사항이 포함돼 있다.
지침 초안은 연구에서 치료 노출, 결과 및 기타 중요한 요소를 정의하기 위한 고려사항을 제공한다. 지침 초안에는 데이터 품질 보증 및 데이터 품질 관리 절차에 대한 고려사항도 포함돼 있다. 이 지침 초안의 권고사항은 EHR 또는 의료 청구 데이터를 사용해 규제 목적을 위한 의약품 또는 생물학적 제품의 안전성 또는 효과성을 입증하는 것을 목표로 하는 모든 연구 설계와 관련이 있다. 이 지침 초안은 FDA가 RWE 프로그램을 지원하기 위해 발표할 계획인 일련의 지침 중 일부이다. 이 지침 초안을 발표하는 것은 21세기 치유법에 따른 FDA의 의무를 충족하는데 도움이 되며, 의약품 안전성 또는 효과성에 대한 규제 의사결정을 위해 실세계 근거를 사용하는 지침을 발표하기 위한 처방의약품 사용자 수수료법(Prescription Drug User Fee Act) 목표를 충족시킨다.
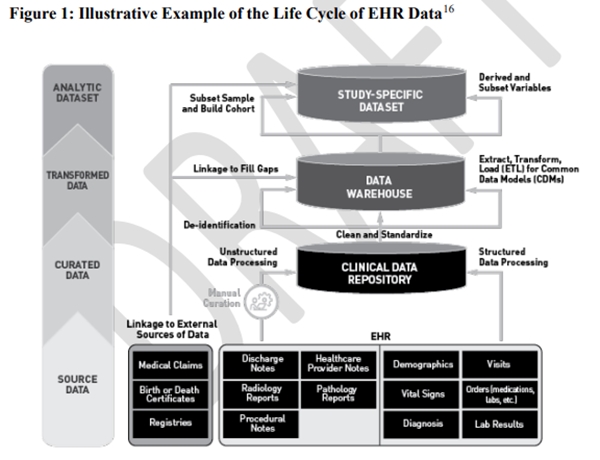
이 지침은 연구질문을 적절하게 다루는 데이터소스의 선택, 연구설계 요소에 대한 정의의 개발 및 검증, 그리고 데이터 발생부터 최종 연구별 데이터세트에 이르기까지 연구 전반에 걸친 데이터 출처 및 질을 포함해 EHRs 및 청구 데이터에서 수집한 RWD 사용과 관련된 3가지 문제에 중점을 둔다. FDA는 EHRs 또는 의료 청구 데이터에서 얻은 RWE에 의존하는 연구의 스폰서가 연구 프로토콜 및 통계분석 계획을 FDA에 제출하고 연구를 진행하기 전에 관련 검토부서에 의견을 요청하거나 회의를 요청해야 한다고 강조한다. 이러한 프로토콜은 데이터와 관련된 설명 정보와 함께 연구에 포함될 모든 데이터 소스를 식별해야 한다. 이 지침은 데이터의 발생 및 큐레이션에서 데이터의 변환 및 익명화 및 데이터 웨어하우스의 최종 저장 및 연구별 데이터세트의 생성에 이르기까지 데이터 수명주기 동안 데이터 질 고려사항을 설명한다.
|
시사점 |
출처원 :
Docket Number: FDA-2020-D-2307. Oncology Center of Excellence (OCE), Center for Biologics Evaluation and Research (CBER), Center for Drug Evaluation and Research (CDER). US Food and Drug Administration (FDA). U.S. Department of Health and Human Services (HHS). September 29, 2021.
https://www.fda.gov/regulatory-information/search-fda-guidance-documents/real-world-data-assessing-electronic-health-records-and-medical-claims-data-support-regulatory?utm_medium=email&utm_source=govdelivery
https://www.fda.gov/media/120060/download?utm_medium=email@utm_source=govdelivery
* 본 컬럼은 의료기기를 비롯한 헬스케어 분야의 국내외 학회지에 발표된 논문 및 연구보고서 등을 살펴봄으로써 우리나라 의료기기 관련 보건의료정책 마련에 통찰력을 제공하기 위한 목적으로 매주 발표됨