이상수의 Health policy insight
● [Health Policy Insight 293회]
호주의 의료기술평가(health technology assessment, HTA) 제도: 의약품 및 의료서비스

Medtronic North Asia
(Korea and Japan)
대외협력부 전무
1992년 호주는 신약의 보험급여를 고려할 때 의사결정자에게 의료기술평가(health technology assessment, HTA) 근거를 제출하도록 요구하는 최초의 국가 중 하나가 되었다. 그 이후로 HTA는 호주에서 수술, 진단검사 및 의료기기의 보험급여를 위해 도입되었다.
호주 약제급여제도 개요(Brief Description of the Australian Pharmaceutical Benefits Scheme (PBS))
호주 약제급여제도(pharmaceutical benefits scheme, PBS)는 필요한 의약품에 대해 지불가능하고 공평한 접근성을 제공하는 것을 목표로 하는 연방정부 보조금 제도이다. 모든 의약품은 PBS를 통해 정부 보조금을 받기 전에 포괄적인 평가 프로세스를 거쳐야 하며 제약회사가 PBS에 신약 포함 신청서를 제출한다. 이러한 제출은 PBS에 신약 포함 여부에 대해 정부에 권고하는 ‘약제급여자문위원회(Pharmaceutical Benefits Advisory Committee, PBAC)’에 의해 평가된다. 호주 정부는 PBAC이 의약품 등재를 권고하지 않으면 PBS에 의약품을 등재할 수 없다. 반면에 PBAC은 독립적 법정기구이며 정부는 PBAC 권고 의약품을 PBS에 등재하지 않도록 선택할 수 있다. 또한 PBAC은 국가 예방 접종 프로그램(National Immunisation Program schedule)에 포함될 새로운 백신을 고려한다. PBAC은 의사, 의료전문가, 보건경제학자, 소비자 대표 및 산업계 지명 회원으로 구성된다. 회원의 1/3은 보건부장관이 지명하고 나머지는 전문기구에서 지명한다.
PBAC 제출 프로세스(PBAC Submission Process)
신약은 인허가 절차와 병행하여 PBAC에 제출할 수 있으며 인허가 서류가 호주 인허가당국(Australian Therapeutics Goods Administration, ATGA)에 제출된 경우 PBAC에 제출이 허용된다. 그러나 PBAC은 긍정적인 TGA 대리인의 검토가 없는 경우 신청을 고려하지 않는다. 또한 PBS 등재는 신청된 적응증에 대해 치료제품 등재(Australian Register of Therapeutic Goods, ARTG)에 의약품이 등록되기 전에 이루어지지 않는다. 제출은 주요(major) 또는 경미한(minor) 제출로 구분된다. 주요 제출은 신약 또는 현재 등재된 의약품의 새로운 적응증이며, 경미한 제출은 일반적으로 기존 등재 의약품의 변경 또는 유사 제품과 관련된다. 초기 제출이 거절된 후 다시 제출할 수도 있다. PBAC 신청은 17주 주기(17-week cycle)로 진행되며 3월, 7월, 11월에 1년에 3회 제출이 가능하다. 주요 제출과 경제성 모델(economic models)은 주기의 첫 10주 동안 외부그룹(사전 승인된 여러 그룹에서 선택됨)에 의해 평가되며 평가보고서(evaluation report)는 스폰서에게 전송된다(그림1). 스폰서는 1주일 내에 보고서에 응답해야 한다. 제출, 평가보고서 및 회사 응답은 PBAC의 2개 기술소위원회(technical subcommittees)에 전달된다: 경제성 소위원회(Economic Subcommittee, ESC) 및 의약품 이용도 소위원회(Drug Utilization Subcommittee, DUS). ESC는 임상 및 경제성 근거를 평가하고 이러한 평가의 기술적 측면에 대해 PBAC에 조언한다. DUS는 의약품의 예상 사용량과 재정적 비용을 평가한다. 2개 소위원회에서 제공한 조언은 최초 제출 후 15주 차에 회사에 제공되며 회사는 1 주일 이내에 응답해야 한다. 개인, 의료전문가 및 기타 이해관계자 의견은 PBAC 회의 최대 3주 전에 온라인 양식을 통해 제출할 수 있다. PBAC는 제출 후 약 17주 후에 회합한다.

제출 구조(Submission structure)
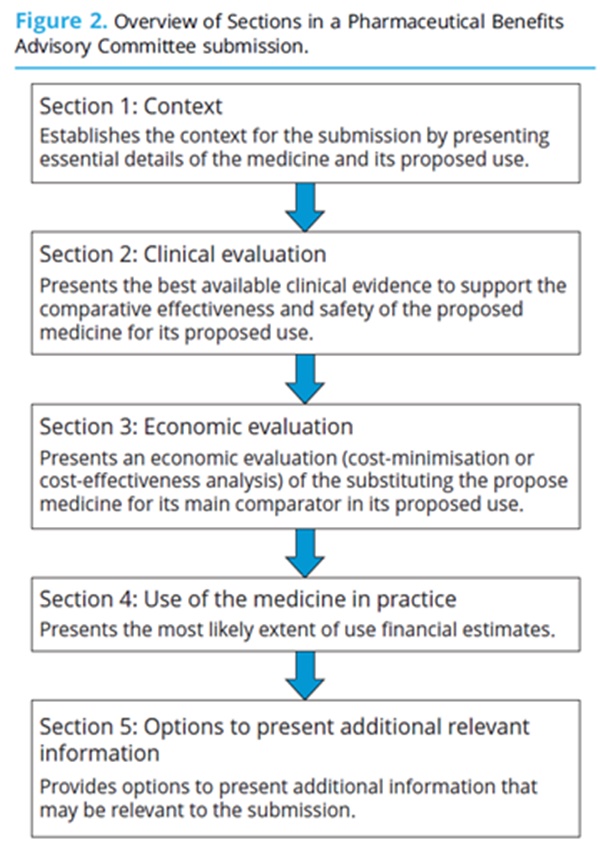
PBAC 제출은 PBAC 가이드라인에 기술된 대로 5개 섹션(sections)을 포함해야 한다 (그림2). 섹션1은 임상 알고리즘을 제시하고, 비교대상(comparators)을 정당화하고, 제안된 제한사항을 제시하는데 이용된다. 섹션2에서는 임상근거가 제시된다. 체계적 문헌고찰(systematic reviews)은 가장 관련성이 높고 최신의 근거를 얻기 위해 이용된다. 우월성(superiority) 또는 비열등성(noninferiority)에 대한 주장을 뒷받침하기 위해 임상 시험과 관련 데이터에 대한 철저한 평가가 요구된다. 경제성 평가(economic evaluation)는 섹션3에 제시된다. 임상적 우월성 주장은 가장 일반적으로 비용효과분석(cost effectiveness analysis)으로 이어지며, 비용효용분석(cost utility analysis)이 선호되는 비열등성 주장은 비용최소화분석(cost minimization analysis)으로 이어진다. 예산영향 모델(budget impact model)은 대체 시나리오의 민감도분석(sensitivity analysis)을 포함하여 이용가능성이 가장 높은 사례로 섹션4의 일부로 제시된다. 이러한 재정적 추정치는 PBS 등재를 위해 신약이 권고되는 경우 재무적 계약(financial agreements)의 기초를 형성한다. 마지막으로, 제약회사는 섹션5에서 기타 추가 관련 정보를 제시할 기회가 있다.
PBAC 회의 후(After the PBAC meeting)
PBAC 회의 결과는 PBAC 회의 3~5주 후에 회사에 전달된다. 공개 요약문서(public summary document)는 PBS 웹사이트에서 회의 16~18주 후에 게시된다. 제약회사는 연구 보고서의 미공개 데이터 및 예산영향 모델의 재무계획과 같은 기밀정보(commercial in confidence)의 수정을 요청할 수 있다. 긍정적인 권고 후, 회사와 보건부는 가격 조건(예를 들어, 특별 가격책정 약정), 사용 제한 및 재정 위험분담 계약을 포함하는 계약증서를 마무리한다. (비용 최소화 또는 비용 효과성을 기준으로) 신약이 제공될 때 기존 PBS 등재 의약품의 이용가능성에는 변화가 없다. 드물게 오래된 기존 의약품은 스폰서의 요청에 따라 또는 초기 시장 진출 후 발견된 안전성 문제로 인해 삭제될 수 있다. 특별 가격책정 약정(special pricing arrangements)은 게시된 가격과 다른 유효 가격을 의미한다. 일반적으로 기밀의 환불(rebate)을 수반하며 호주가 다른 국가의 제품 가격에 영향을 주지 않고 의약품에 접근할 수 있도록 하기 위한 메커니즘이다. PBAC 결정이 미권고일 경우 회사는 신청서를 다시 제출하도록 선택할 수 있다. 경우에 따라 독립적 검토(independent review)를 요청할 수 있다.
호주 의료급여목록 개요(Brief Description of the Australian Medical Benefits Schedule)
메디케어 급여가 적용되는 서비스는 의료급여목록(Medical Benefits Schedule, MBS)에 명시되어 있으며, 대량 예방접종 및 보험 목적의 건강검진을 포함한 일부 서비스는 제외된다. MBS에 등재된 대부분의 항목은 인센티브 지불보상(incentive payments) 또는 특정 범주의 환자에 대한 본인부담금 또는 갭 지불보상(gap payment) 없이 서비스를 제공하는 것과 같은 다른 유형의 의료인 지불보상 방법에도 불구하고 행위별 수가제 기준으로 보상된다. 메디케어 급여 수준은 행위별 수가제에 대해 의무적으로 부과되는 수가의 백분율로 계산되며 서비스가 발생한 장소에 따라 다르다. 예를 들어, 병원에서 제공하는 서비스는 수가(schedule fee)의 75%에 해당하는 급여를 받고, 병원 외부에서 제공되는 서비스는 일반적으로 수가의 85%를 급여 받고, 비의뢰(non-referred) 진료의 경우 급여는 100%로 설정된다. MBS는 오래된 서비스 삭제와 새로운 서비스 포함과 더불어 수가 조정을 위해 정기적으로 갱신된다(가장 일반적으로 전국 임금가격과 소비자 물가지수 변화에 근접하게 조정). 현재 5,745개 항목에 비해 1974년 MBS는 약 2,163개 항목으로 구성되었다. 2018년 7월부터 2019년 6월까지 전체 정부 의료예산의 약 33.7%인 241억 달러의 비용으로 4억 2천 420만 건의 서비스가 MBS에 의해 보험급여되었다. 각 MBS 항목에 대한 환불 설정은 대체로 오랜 시간에 걸쳐 이루어졌다. 그러나, 제안된 새로운 (또는 수정된) 서비스에 대한 공식적인 의료기술평가는 안전성, 효과성, 비용 효과성 및 예산영향을 평가한다. 1998년 의료서비스 자문위원회(Medical Services Advisory Committee, MSAC)가 설립되어 신규 및 기존 의료시술이 안전성, 효과성, 비용효과성 및 총 비용에 대한 근거로 뒷받침되도록 했다.
호주 의료서비스 자문위원회(Australian Medical Services Advisory Committee)
MSAC는 1년에 3회 회의를 개최하며 임상 의학, 보건경제학 및 소비자 문제에 대한 전문지식을 갖춘 개인으로 구성된다. 2개의 소위원회인 ESC와 PICO 자문 소위원회(PICO Advisory Sub-Committee) (공식적으로 프로토콜 자문 소위원회 - Protocol Advisory Sub-Committee, PASC)가 지원한다. PASC 위원회의 초점은 신청을 통해 제안한 의료서비스의 모집단(population), 중재(intervention), 비교대상(comparator) 및 결과(outcomes) -PICO를 확인하는 업무이다. ESC의 초점은 평가보고서에 제시된 임상 근거 및 경제성 평가를 자세히 고려하고, 평가의 질, 타당성 및 관련성에 대한 조언을 제공하며, MSAC가 고려할 이슈를 확인하는 것이다. 그림3은 단계 및 위원회 또는 소위원회 참여를 포함하여 전체 MSAC 프로세스를 개략적으로 보여준다. 일부 신청은 전체 평가(full assessment)가 필요하지 않을 수 있으므로 특정 신청마다 다를 수 있다.

사전 평가(Preassessment)
이 단계의 목적은 신청자가 프로세스, 가능한 경로 및 근거 기대치를 알고 있는지 확인하기 위함이다. MSAC 프로세스는 연방 보건부(Commonwealth Department of Health)에서 자금을 지원하고 신청자로부터 비용을 회수하지 않으므로, MSAC 프로세스를 통해 신청을 시작하는 것이 공공 자원을 적절하게 사용하는지 여부에 대한 결정이 내려진다. 이러한 결정은 일반적으로 제안된 서비스가 건강보험법(Health Insurance Act, 1973)에 따른 전문서비스 정의를 충족하는지 여부를 기반으로 한다; 그리고 제안된 서비스와 관련하여 확인된 중요한 정책 또는 시행 이슈가 있는지 여부. 마지막으로, 평가는 신청이 HTA 프레임워크 또는 비HTA 프로세스를 통해 고려되어야 하는지 여부를 결정하기 위해 신청의 유형과 구체성에 따라 분류된다. HTA 경로는 순 임상적 영향(net clinical impact)을 측정할 수 있는 신청에 적합한 것으로 간주된다. 이 단계에서는 표적 공개 자문(targeted public consultation)도 실시된다.
PICO 확인(PICO confirmation)
이 단계의 목적은 PICO를 개발하고 평가 진행을 위한 관련 임상 알고리즘을 확인하고 결정하는 것이다. HTA 그룹(사전 승인된 다수 그룹에서 선택됨)은 PICO의 각 요소를 명확하게 표현하기 위한 PICO 확인 및 평가보고서에 제공될 후속 경제성 평가를 위한 결정 분석 프레임워크(decision analytic framework)를 개발하기 위해 보건부와 계약을 맺는다.
신청 평가(Application assessment)
평가보고서는 계약 평가(contracted assessment) 또는 제출 기반으로 실시된다. 계약 평가의 경우, 보건부 고려를 위해 필요한 MSAC 문서를 개발하고 준비하는 것과 관련된 비용을 마련, 조정 및 처리한다. 보건부를 통해 촉진되지만, 신청자는 평가를 수행하기 위해 계약된 HTA 그룹에 참여할 수 있다. 반면 신청자는 제출 기반 평가(submission-based assessment) 접근방식에 따라 MSAC 문서를 개발하고 준비하는 것과 관련된 비용을 마련, 조정 및 처리할 책임이 있다. MSAC에 제출할 평가보고서를 준비하기 위해 평가보고서 구성과 관련된 정보는 각 기술 가이드라인(technical guidelines)에 이용 가능하다. 평가보고서에는 다음 섹션이 포함된다: 요약, 문맥, 임상 평가, 전환 이슈(translation issues) (임상적 평가와 경제성 평가 간의 연계), 경제성 평가, 재정적 영향 및 기타. 공식적인 공개 자문 또는 프로세스 전반에 걸쳐 접수된 피드백 요약과 소비자 영향 진술서도 평가보고서와 함께 제공된다. 평가보고서 제출에 대한 선택적 2단계 접근방식은 문맥과 임상적 평가 섹션을 먼저 평가한 후 후속 라운드에서 평가를 위한 경제성 평가 및 재정적 영향 섹션을 준비하고 제출하는 경우 가능하다. MSAC 프로세스의 평가 단계는 사전평가(preassessment) 단계 만큼 크게 다르지 않다. 보건부가 평가보고서(제출 기반 또는 계약)를 받으면, MSAC 프로세스의 평가 단계는 약 4개월이 소요되고 ESC와 MSAC 고려 간에 약 6주가 소요된다.
사정(Appraisal)
보건부 장관에 대한 MSAC의 조언은 MSAC 조언에 대한 근거를 설명하는 공개 요약 문서의 형태로 공개되며 MSAC 웹사이트에서 게시된다. MSAC은 MBS 수가에 대한 조언을 제공하지만, 이를 정하지는 않는다. 새로운 항목 제안에 대한 MSAC 기술 가이드라인 내에서, 신청자는 모든 장비 및 소모품 비용을 포함하여 제안된 의료 서비스를 제공하는데 필요한 비용을 표시하고 제안된 의료서비스를 일반적으로 수행하는 데 걸리는 시간을 정해야 한다. 신청자는 비교를 위해 제안된 서비스의 시간, 복잡성 또는 장비 사용을 대략적으로 추정할 수 있는 현재 MBS에 등재된 다른 서비스를 확인하고 제시할 수 있다. 이러한 입력을 기반으로 신청자는 제안된 서비스에 대한 MBS 수가를 제공해야 하며 이는 비용효과분석에 포함된다. 이는 MBS 수가가 입력 비용에 근거하지만 공식 HTA를 통해 금전적 가치를 기준으로 평가된다는 것을 의미한다. MSAC가 MBS에 서비스를 등재하도록 긍정적 권고를 내리면, 보건부는 MBS 수가를 확정하기 위해 자문을 할 수 있다. 최종 수가가 MSAC이 고려한 제안된 수가와 크게 다를 경우, 추가 고려를 위해 제안된 수가와 함께 신청을 MSAC로 다시 보낼 수 있다.
상호의존적 기술(Codependent Technologies)
기술은 조합된 사용(순차적 또는 동시적)이 기술의 임상적 효과를 향상시킬 때 상호 의존적이다. 현재까지 호주에서 평가된 대부분의 상호의존적 기술은 의약품 또는 검사 조합으로, 신약이 PBS에 등재되고 있으며 환자 선택 및 새로운 고비용 의약품에 대한 적격성을 개선하기 위해 관련 진단검사가 요구된다. 관련 검사는 동시에 MBS 등재를 추구한다. 제출은 MSAC와 PBAC에서 동시에 또는 공동으로 고려할 수 있다. 공동으로 고려할 제출은 통합된 상호의존적 제출(integrated codependent submission)이라고 하며 제출이 2개 위원회에 모두 전달되어야 하기 때문에 종종 의사결정에 더 많은 시간이 소요된다. 간소화된 상호의존적 제출(streamlined codependent submissions)이라고 알려진 동시 제출(parallel submission)은 동시에 제출되며 위 섹션에 설명된 표준 프로세스를 따른다. 어떤 경로를 취할지는 몇 가지 요인에 따라 달라진다: 예를 들어, 의약품이 과거에 상호 의존성이 고려된 치료제(therapeutic class)에 속하는지, 과거에 PBAC 및 MSAC에 제출한 적이 있는지 여부. 상호의존적 기술을 평가하는 방법과 관련하여 호주에는 여러 옵션이 있다. 상호의존적 기술에 의료서비스 및 진단검사가 포함되는 경우, MSAC 상호의존적 신청이 필요하다. 상호의존적 기술에 의약품 조합이 포함되는 경우 PBAC 상호의존적 신청자가 필요하다. 상호의존적 기술에 진단검사(또는 상담 서비스) 및 치료 의약품이 포함되는 경우, MSAC 또는 PBAC 상호의존적 신청이 필요하다. MSAC 또는 PBAC 상호의존적 신청은 MSAC의 PASC 기간을 따르며 최종 제출은 (앞서 설명한 프로세스에 따라) MSAC 및 PBAC 로 간주된다.
PBAC 및 MSAC의 진화와 미래(Evolution and Future of PBAC and MSAC)
호주 HTA 프로세스는 인허가 및 보험급여 동시 검토(parallel regulatory and reimbursement process) 프로세스, 정해진 17주 평가 주기, 특별 가격책정 약정을 통한 가격 유연성, 관리형 급여계약(managed entry schemes) 및 위험분담계약(risk share agreements)의 도입으로 수년간 발전해 왔다. 특별 가격책정 약정 이용에도 불구하고, 관리형 급여계약 및 위험분담계약의 이용은 MBS 등재와 달리 PBS에 주로 사용되었다. HTA 방법은 신기술이 이용가능해짐에 따라 발전한다. PBAC과 MSAC와 같은 HTA 기관의 주요 도전과제는 HTA 가이드라인이 적시에 갱신되도록 하는 것이다. 불행히도 이것은 자원과 시간이 많이 소요되며 다양한 이해당사자의 동의가 필요하다. PBAC 가이드라인의 주요 개정은 1992년 이래 4회, 갱신 간격은 2~11년이었다. 새로운 기술과 관련하여 당면 과제가 있다. 위험분담 및 관리형 급여계약을 통해 보험자는 초기 근거를 기반으로 기술을 보험급여 할 수 있으며, 이는 자연스럽게 더 많은 불확실성을 가져온다. CAR-T 치료법과 같은 고가의 맞춤형 의약품(personalized medicine)의 접근성에 대한 환자 및 옹호단체의 압력이 증가하고 있다. 다른 미래 이슈는 보험급여 프로세스 및 제약, 의료서비스 및 의료기기 간의 일관성과 관련된다. 예를 들어, MSAC 프로세스는 추가 PASC 단계로 인해 PBAC 프로세스 보다 오래 소요된다. 더욱이, 특히 임상 근거의 수준이나 유형과 같은 비모수적 불확실성과 관련하여 임상 또는 경제적 불확실성의 수용과 관련하여 위원회가 얼마나 상이한지, 그리고 건강 결과(health outcome)의 가치가 위원회 간 얼마나 상이한지 (가령 질보정수명연수) 불확실하다.
호주 HTA 프로세스의 강점은 보험급여 제출에 대한 평가가 호주의 학계 및 기타 독립적 그룹에 의해 독립적으로 수행된다는 것이다. 호주 정부가 HTA를 조기에 채택한 결과 다른 국가에 비해 고도의 보건경제학자 또는 HTA 전문가 역량이 증가했다고 주장할 수 있다. 그러나 특히 경제성평가 테크닉의 경우 2개 기관 모두 현대적 HTA 실행을 채택하는 것을 꺼려했다. 예를 들어, 어느 위원회에서도 경제적 불확실성을 평가할 때 확률적 민감도분석(probabilistic sensitivity analyses)이 요구되지 않는다. 그러나, 호주의 의료연구미래펀드(Medical Research Future Fund) 도입은 이제 PBAC과 MSAC이 호주에서 HTA 연구의 공공 기금마련에 영향을 미치거나 형성할 수 있는 자금마련 메커니즘을 확립했다. 마지막으로 제출, 평가, 가격책정 및 의사결정의 투명성을 둘러싼 논의가 증가하고 있다. 옹호자들은 이것이 환자와 의사와 같은 헬스케어 이해당사자들에게 중추적이며 HTA에 대한 역량이 부족한 국가의 프로세스를 개선할 것이라고 주장한다. 투명성은 특정 이슈에 대한 세부정보를 제공하고 연구자와 제약회사가 의사결정 방법을 더 잘 이해하도록 돕지만 몇 가지 이슈가 제기된다. 이전 섹션에서 설명한 것처럼 게시되지 않은 데이터 및 민감한 상업정보는 제출 프로세스의 일부이다. HTA를 기반으로 한 의사결정은 본질적으로 비용효과성과 관련이 있으며, 이는 기술의 가격(환불 포함)에 따라 달라진다. 완전한 투명성은 제약회사가 국제 참조 가격책정(international reference pricing)으로 인해 다른 시장의 가격책정을 위협하지 않고 "거래(deals)"를 하기 어렵게 만든다.
|
시사점 |
출처원 : Kim H, et al. Value Health Reg Issues. 2021; 24:6–11. https://www.ispor.org/publications/journals/value-in-health-regional-issues/abstract/Volume-24--Supplemental-C/Health-Technology-Assessment-in-Australia--The-Pharmaceutical-Benefits-Advisory-Committee-and-Medical-Services-Advisory-Committee?utm_medium=email&utm_source=database&utm_campaign=value_in_health_regional_issue&utm_term=health+technology+assessment+in+australia:+the+pharmaceutical+benefits+advisory+committee+and+medical+services+advisory+committee&_zs=v4XaX&_zl=itbd2
* 본 컬럼은 의료기기를 비롯한 헬스케어 분야의 국내외 학회지에 발표된 논문 및 연구보고서 등을 살펴봄으로써 우리나라 의료기기 관련 보건의료정책 마련에 통찰력을 제공하기 위한 목적으로 매주 발표됨

