‘ISO 10993-18(chemical characterization: 화학적 특정화): 2020'를 중심으로
● 의료기기산업 미래를 향한 연속 제언 ⑦
“인체접촉 의료기기의 안전성 평가 패러다임 변화 대비해야”
'ISO 10993-18(chemical characterization: 화학적 특정화): 2020'를 중심으로

동국대
의료기기산업학과
객원교수
왜 화학적 특정화인가?
ISO 10993-1:2018는 생물학적 안전성 시험을 체크박스(check box) 접근 방식에서 벗어나 독성 위험평가와 화학적 특정화 데이터를 결합해 평가하도록 규정하고 있다. 즉 획일적이고 일률적인 접근 방식에서 벗어나 임상사용시 의료기기에서 방출될 수 있는 화학물질을 완전히 이해함으로써 합리적인 생물학적 안전성을 평가하도록 권장하고 있다. 화학적 특정화를 활용하면 시판 전후 안전관리시 시간·비용을 절약할 수 있을 뿐만 아니라 동물 희생을 줄일 수 있는 등 많은 이점이 있다.
화학적 특정화는 의료기기의 특징인 잦은 원재료 변경, 제조공정 등 변경에 비교적 쉽게 대응할 수 있다. 변경 발생시 기존의 방법으로는 생물학적 안전성에 영향을 미치는 원인(추출/용출될 위해 물질의 종류와 양)을 특정화할 수 없어 막대한 비용과 시간을 들여 생물학적 안전성 시험을 다시 해야 할 경우가 발생했다. 이런 이유로 생물학적 안전성 재시험 여부, 과거 성적서 인정 여부, 허가/인증 변경 여부 등 민원이 발생할 수 있다. 제반 문제점을 해결할 구체적이고 명확한 방법이 ISO 10993-18(chemical characterization: 화학적 특정화)(2020.1공포)에 제시됐다.
화학적 특정화 중요성
ISO 10993-18(chemical characterization):2020는 의료기기로부터 방출된 위해물질(hazards) 즉 화학물질을 평가하기 위해 추출물(Extractables) 및 용출물(Leachables) 개념을 도입했다. 흔히 두 가지 개념은 의료현장에서 혼돈해 사용되고 있었는데, 개정 ISO에서는 명확히 구분하고 정의가 기술돼 있다.
인체내 방출(release)된 추출물/용출물은 위해물질이므로 생물학적 안전성에 영향을 미친다. 따라서 화학적 특정화란 의료기기로부터 추출/용출된 위해물질을 확인(identification)하고, 그 양이 기준치 이하인지 아닌지를 특정화하는 평가방법이다. 최종적으로 화학적 특정화로 도출된 추출물/용출물 데이터는 리스크평가(ISO 10993-17)와 결합해, 생물학적 안전성 시험실시 여부를 판단하는 중요한 근거자료로 사용된다.
화학적 특정화 주요 내용
(가) 화학적 특정화 대상 범위(ISO-10993-1: B.4.1.1 Chemical characterization 참조)
ISO는 인체접촉 의료기기의 안전성/성능에 영향을 미치는 의료기기를 구성하는 모든 물질 즉 의도적/비의도적 모든 구성물질을 화학적 특정화 대상 범위로 간주하고 있다. 화학적 특정화 대상은 기본원료 (base material, 흔히 식약처 허가시 원재료라고 함)뿐만 아니라 저분자 제조과정→기본원료 제조과정(고분자중합)→의료기기 생산과정→멸균과정→포장과정→운반(보관)과정에 이르기까지 과정 중에 의도적/비의도적으로 함유된 화학성분(chemical constituents)과 화학성분을 구성하는 물질(substance)이다 (그림1). 제조시 이외에도 운반이나 보관공정에서의 오염, 제품 표시 인쇄 및 2차 포장으로부터의 오염, 멸균처리 등에서의 원재료 변형 등이 포함된 포괄적인 개념이다. 다만 식약처 허가/인증서에 기재되는 원재료는 주로 기본 원재료(base materials) 중심으로 작성한다.
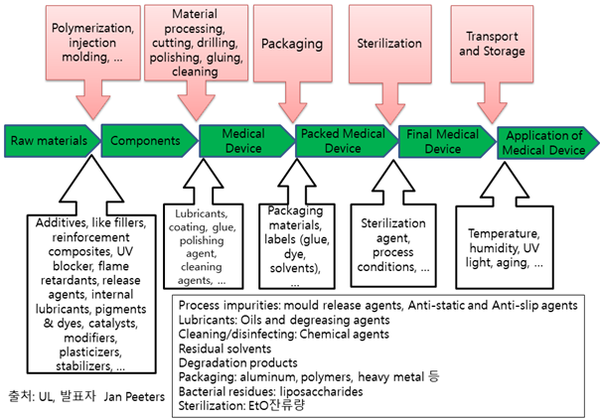
(나) 화학적 특정화 절차
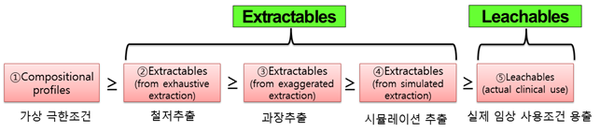
첫 번째 단계인 ①compositional profiles (가상 극한조건)은 의료기기 제조에 첨가/부가된 화학성분 및 그 첨가량이 남김없이 모두 인체에 방출 흡수된다는 가상의 최악 조건을 가정한 조건이다(그림2). 첨가된 화학물질의 양이 분석적 평가 기준값((AET: Analytical Evaluation Threshold) 이하라면 화학적 특정화 절차는 완료되며, 관련 생물학적 안전성 시험 항목은 면제될 수 있다. AET값 이상인 성분만 다음 단계인 추출물시험으로 넘어가는 시스템이다. 다음 단계인 추출물(Extractables)에서도 추출량이 AET보다 높은 성분만 그다음 단계인 용출물(Leachables) 시험단계로 넘어가게 된다. 최종 단계인 ⑤용출물(Leachables)에서는 AET이상인 물질만 선택해 독성데이터 기준값(여기서 기준값은 TI :tolerable daily intake)과 비교해 TI값보다 높은 경우에만 생물학적 시험을 수행한다. 의료기기로부터 방출되는 양은 ①≥②≥③≥④≥⑤순서이다.
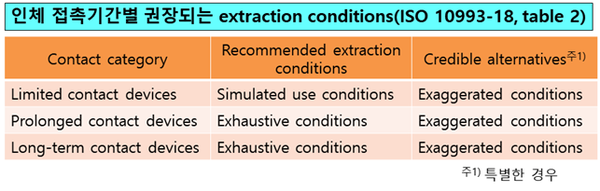
특히 추출물(Extractables) 시험시(②∼④단계) 시험조건이 매우 중요한데 인체 접촉기간별 추출조건이 달라진다(그림3). 이식 의료기기의 경우 ②∼④단계 중 ②철저추출(exhaustive extraction)을 권장하고 있다(ISO 10993-18 D.2). 이때 사용되는 용매는 극성과 비극성 2가지를 사용하도록 권장하고 있으며 그 예시를 제시했다. 미FDA는 용매선정 시 ISO보다 더 엄격한 3가지를 사용하도록 권장하고 있다.
(다) 추출물/용출물 평가에 도입된 AET개념
개정 ISO는 추출물/용출물의 시험분석 결과를 평가하기 위한 screening방법으로 AET를 도입했다. AET을 활용하면 추출·용출된 불특정 미량성분의 특정화 및 위해도 평가 수준을 판단할 수 있다. 즉 AET을 초과한 성분에 관해서만 확인(identification), 특정화, 리스크 평가를 수행하고, 미만인 성분은 안전하다는 개념이다
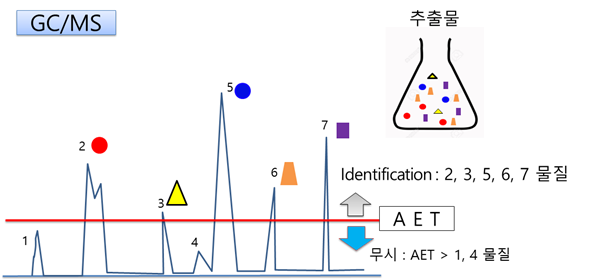
예를 들면(그림 4) 추출물 시험결과 AET보다 작은 성분(그림4의 빨간 선 아래에 속한 성분) 즉 1 및 4성분은 생물학적으로 안전하다는 것이다. 따라서 AET보다 큰 성분(그림4의 빨간 선 윗부분에 속한 성분) 즉 2, 3, 5, 6, 7 성분에 대해서만 위험분석을 수행하면 된다. 추출물 시험결과 모든 성분의 양이 AET보다 낮은 값이라면 그 제품에 대한 생물학적 안전성 평가시험은 불필요하다.
(라) 시험 신뢰성을 반영한 uncertainty factor(Uf)
AET은 추출시험 평가에 활용돼 위해성 여부를 판가름하는 1차 관문으로 매우 중요하다.
AET산출에 표준물질 사용 여부, 시험장치 선정 타당성 여부, 시험기관 수준 등을 반영한 uncertainty factor(Uf)를 적용하도록 하고 있다. 예를 들어 특정 성분 0.30 /mL 검출됐는데 표준물질을 사용 안 했다거나, 시험장비 선정 타당성 등이 부족할 경우 감점(Uf)을 반영해 AET을 0.30 /mL → 0.15 /mL으로 변경해야 한다
화학적 특정화가 적용되는 생물학적 안전성 시험항목
화학적 특정화로 평가된 위해물질의 양이 기준값 이하이면 모든 생물학적 안전성 시험을 하지 않아도 된다고 오해하고 있다. 화학적 특정화 원리를 알면 쉽게 이해할 수 있다. 화학적 특정화는 추출/용출된 위해물질이 인체에 전신 흡수될 경우를 가정해 평가하는 시스템이다. 따라서 화학적 특정화로 면제될 수 있는 생물학적 안전성시험은 급성독성, 아급성, 아만성, 유전독성, 발암성(유전적인 인자에 의해 발현되는 발암성의 경우에 한함) 등 전신독성시험에 해당한다. 따라서 국소적 시험 또는 물리적 특정화(physical characterization) 등의 영향을 받는 독성시험인 발열성, 세포독성, 자극성시험 및 감작성(제한적으로 인정되기도 함), 혈액적합성, 이식시험, 발암성(구조에 의해 발생 또는 비유전적인 인자에 의해 발생하는 발암성) 등에는 적용되지 않는다.
화학적 특정화에 대비한 제안
생물학적 안전성 표준을 관리하는 ISO위원회는 화학적 특정화가 의료기기의 안전 평가를 위한 미래 표준의 원동력이 될 것이라고 밝혔다. 향후 ISO 표준위원회와 미FDA등 규제기관은 향후 화학적 특정화에 더 중점을 둘 것이다. 즉 화학적 특정화에 부족한 부분을 동물시험(in vivo)으로 채우는 생물학적 안전성 시스템 분야에서의 대전환이 진행되고 있다. 즉 동물시험을 생물학적 안전성 평가의 보조 수단으로 사용하겠다는 것이다. 이에 대한 대비로 신청인, 시험기관, 규제기관에 다음을 제안하고자 한다.
신청인은 원재료 및 제조 정보를 충분히 제공할 수 있어야 정확한 화학적 특정화가 가능하다. 이를 위해서는 원재료 공급자(supplier, vendor), 제조자와 긴밀한 소통이 필요하다. 제조공정 및 원재료에 대한 정보가 없는 화학적 특정화는 바닷가 모래밭에서 바늘 찾는 일과 같다. 여기서 원재료란 앞서 언급한 바와 같이 가본 원료(base material)만을 의미하지 않는다. 충분한 정보 제공 없이는 부정확한 화학적 특정화가 우려되며, 시간과 비용 또한 많이 소요된다.
시험검사기관은 신뢰성 있는 성적서를 발급해야 한다. 이를 위해서는 표준물질 등 확보, 화학물질에 맞는 시험장비·컬럼 등 분석장비 매뉴얼화가 필요하다. ISO에서는 신뢰성이 부족한 분석결과에 대해서는 AET산출시 감점(uncertainty factor)이 된다.
또한, 화학물질 데이터베이스화에 대비해야 한다. 현행 유통되고 있는 많은 화학물질에 대한 데이터베이스가 있어야만 정확한 분석이 가능하다. 분석장비회사에서 제공되는 데이터(library)만 의존할 경우 화학적 특정화에 한계가 있으며 정확도도 떨어진다. 선진 시험분석기관의 화학 물질분석 데이터베이스는 수천 건에서 수만 건이라고 한다.
규제기관은 기준규격화 및 이미 도입된 국가들의 성적서 제출시 심사방향 및 방법에 대해 대비해야 한다. 미FDA, 일본 후생노동성은 이미 ISO 10093-18:2020뿐만 아니라 관련 ISO를 도입 운영하고 있다. 국내 기준규격 도입 전이라도 과학적으로 타당하다면 관련 성적서를 평가할 수 있는 심사 역량 및 체계를 갖춰야 한다. 개정 ISO 10993-18:2020에 따른 평가보고서는 분야별 복잡하게 상호연계돼 있어, 고도의 전문성이 요구된다. 이를 위해서는 전문성을 갖는 심사인력 및 역량이 필요하다. 특히 필요한 전문 분야는 다음과 같다. 특히 △Design Engineers(physical & Chemical) △Material Scientist △Manufacturing engineers △Analytical Chemists △Toxicologists △Regulatory scientist 등 전문 분야는 더욱 요구된다.

