KOTRA, "의료기기 수출 위해서는 규제체계 이해 및 사전등록 필요"
[KOTRA_해외시장동향_2019.7.26]
말레이시아 의료기기 수출을 위한 규제제도 및 등록절차(1)
□ 규제환경
ㅇ 말레이시아의 의료기기관련 등록제도는 2006년부터 자율등록제도가 시행되었고, 2012년에 통과된 의료기기법 (MDA: Medical Device Act) 및 의료기기허가법 (MDAA: Medical Device Authority Act)에 근거하여 2015년부터 말레이시아에서 제조, 수입, 유통되는 모든 의료기기는 주무관청인 의료기기청 (MDA : Medical Dvice Authority)에 등록하여야 한다.
ㅇ 제품등록은 말레이시아의 현지기업만 가능하다. 2015년 시행된 의료기기등록제도는 수차례 유예기간을 연장하였으나, 2018년12월31일자로 유예기간이 종료되었다.
□ 주무관청
ㅇ 의료기기청 (MDA : Medical Device Authority) : 말레이시아 의료기기청은 보건부 산하의 기관으로, 의료기기 제품등록의 주무관청이다. 말레이시아에 있는 의료기기의 품질, 효과, 안전성을 감독하는 역할을 통하여, 공중보건과 안전을 보호하는 것이 설립 목적이다.
ㅇ 원자력 에너지 허가위원회 (AELB : Atomic Energy Licensing Board) : 에너지, 과학, 기술, 환경 및 기후 변화 교육부 (Ministry of Energy, Science, Technology, Environment and Climate Change) 산하의 원자력 에너지 허가위원회 (Atomic Energy Licensing Board, AELB)는 원자력의 규제와 통제를 제공한다. 의료기기의 경우는 방사선 영상장비들의 등록, 수입, 설치, 유지보수, 폐기관련 주무부서이다.
□ 의료기기의 정의 및 분류체계
ㅇ 관계 법령 : 말레이시아 의료 기기의 정의는 2012 년 의료기기법 (법령 737 호) [Medical Device Act 2012 (Act 737) : MDA 2012] 제 2 조에 다음과 같이 규정하고 있다. 이것은 세계 보건기구 (World Health Organization, WHO)의 정의와 거의 같다.
ㅇ "의료기기"라 함은
| (a) 모든 기구, 장치, 도구, 기계, 설비류, 이식재료, 체외 진단시약, 소프트웨어, 재료 또는 기타 유사물질 또는 물품 제조자가 인체에 사용하는 것을 의도하여 단독 또는 조합으로 그 사용 목적이 아래의 하나 또는 그 이상의 목적으로 사용되는 것. 약리학적, 면역학적 또는 신진대사의 수단에 의해 인체에서 주요 작용을 하지는 않으나 기능을 보조하기 위해 이러한 방법을 사용하는 기기. (b) 인체에 사용되는 모든 기구, 장치, 도구, 기계, 장비, 이식, 체외진단시약, 소프트웨어, 재료 또는 기타 유사 또는 관련 물질로 보건부장관이 공공의 안전, 위생 또는 위험을 고려하여, 의료기기라고 공식적으로 공시한 것. |
ㅇ 의료기기의 등급체계
- 의료기기는 인체에 미치는 위험의 정도에 따라 아래표49와 같이 4가지로 분류되며, 이 등급에 의해 등록요건, 심사내용, 기간, 수수료 등이 다르다.
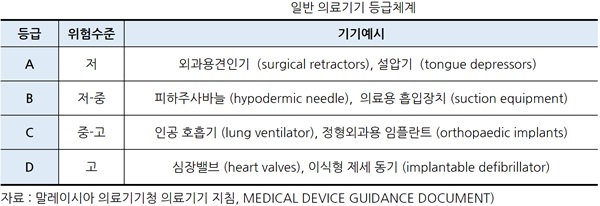
- 특정 의료기기가 의도한 목적을 보다 정확하게 달성 할 수 있도록 '본체' 의료기기와 함께 사용하도록 특별히 고안된 액세서리는 자체 의료기기로 분류하여야 한다. 따라서 이와 같은 액세서리는 '본체' 장치와는 다른 분류(등급)이 될 수도 있다.
- 의료기기에 둘 이상의 규칙이 적용되는 경우 제조업 자의 의도된 용도에 따라 의료기기에 최고 위험수준의 등급으로 분류한다.
- 의료기기가 다른 의료기기와 조합되어 사용되는 경우 등급 분류는 각 의료기기에 개별적으로 적용해야 한다.
- 의료기기 자체에 통합되어 의료기기의 사용 또는 운전에 영향을 미치는 소프트웨어는 의료기기와 동일한 등급으로 분류되어야 한다. (예 : 이미지 향상에 사용되는 소프트웨어). 하지만 소프트웨어가 다른 의료기기와 독립적인 경우는 의료기기의 등급 분류 규칙을 사용하여 자체적으로 분류한다.
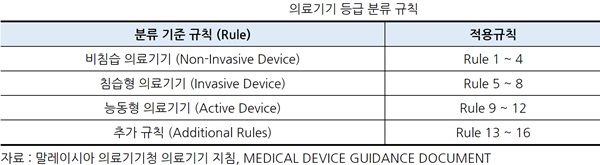
ㅇ 의료기기의 등급 분류 규칙
- 말레이시아 의료기기청의 지침에 따르면 의료기기 등급의 분류규칙은 아래표와 같다.
□ 의료기기 관련 규제제도
ㅇ 의료기기의 필수안전 요건을 담보하기 위하여2012 년 의료기기법 (Act 737 및 Act 738)이 통과되어 시행되고 있다. 의료기기법 (Act 737)에 의거 한 규정은 2006 년에 시행되었던 자발적인 제품등록제도를 대체했다. 현재 말레이시아에서 제조, 수입 또는 유통되는 모든 의료기기는 등록이 필요하다.
ㅇ 관련법령
- ① 의료기기법, Medical Device Act 2012 (Act 737) : 의료기기에 대한 정의, 등급, 등록 절차, 적합성 평가기관 (Conformity Assessment Body) 등록요건에 관한 법률
- ② 의료기기주무관청법, Medical Device Authority Act 2012 (Act 738) : 의료기기주무관청인 Medical Device Authority설립의 근거법. 설립, 구성, 운영, 예산등
- ③ 의료기기규정, Medical Device Regulations 2012 : 의료기기법 2012의 세부규정으로 의료기기 등록, 라이센스 발행, 적합성 평가 절차, 라벨링 등이 어떻게 이루어져야 하는지 규정하고 있다.
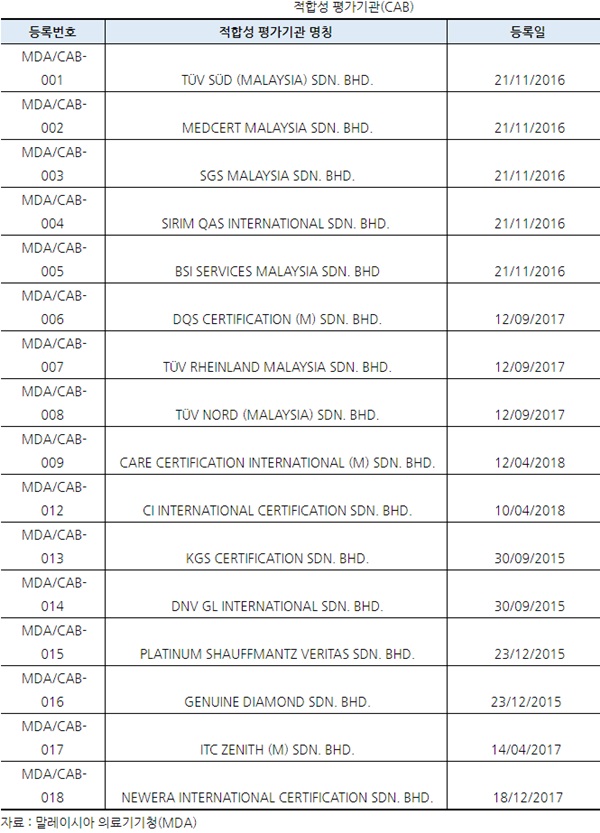
ㅇ 적합성 평가기관 (Conformity Assessment Body : CAB)
- "적합성 평가기관 (Conformity Assessment Body, CAB)"이란 독립적으로 활동하며, A 등급 (Class A)의 의료기기를 제외한 B,C,D등급의 의료기기는 MDA에 등록된 적합성 평가기관 (CAB)에 의한 적합성 평가를 받아야한다. 현재 MDA에 등록된 적합성 평가기관은 모두 16개이다.
- 통상 적합성 평가기관은 말레이시아 현지의 지정대리인 (Authorized Representative)이 선정하나 각각의 적합성 평가기관마다 적합성 평가가 가능한 기술분야가 다르기 때문에 유첨한 세부목록을 확인하여 적합성 평가기관의 선정에도 주의를 기울여야 한다.
□ 기관 라이센스 (EL : Establishment License)
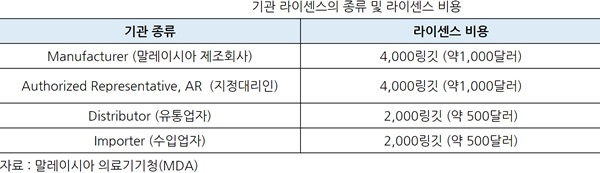
ㅇ 관계 법령 : 의료 기기의 제조업자, 수입업자, 유통업자 및 외국의 의료기기 제조업자에 임명된 지정 대리인 (Authorised Representative, AR)은 MDA 20123의 제 2 조에 따라 "기관"(Establishment)로 규정되어 있으며, 이러한 사업자는 동법 제 15 조에 따라 기관 라이센스 (EL : Establishment License)의 취득이 의무화 되어있다.
ㅇ 기관 라이센스의 종류 및 라이센스 비용 : 기관 라이센스의 종류와 라이센스 비용(신청비용은 250링깃 별도)은 아래표52와 같다.
ㅇ 유의사항 : 의료 기기의 수입은 외국 제조자에 의해 임명 된 AR이 필요하며, 이 AR이 의료기기 등록, 시판 후 조사, 결함보고, 유통기록 등의 보관 의무를 진다. 또한 "기관"은 여러 역할을 할 수있다. 예를 들어, AR이 수입자 및 유통업자가 되는 것이 가능하다.
ㅇ 기관 라이센스 (EL)의 면제 : 2016 년 의료기기 (면제) 령 [Medical Device (Exemption) Order 2016 : MDEO 20164] 제 4 절에 근거하여 아래와 같은 목적에 따라 의료 기기를 수입 또는 제조하는자는 EL의 취득이 면제되는 경우도 있다. 이러한 경우는 ▲개인적인 사용, ▲마케팅 데모용, ▲교육용, ▲의료 기기의 임상 연구 또는 성능 평가 목적, ▲특정 환자를 위해 만들어진 의료 기기, ▲특별한 용도로 사용되는 의료 기기 (예 : 구급용 특수 의료에 사용) 등이다.
ㅇ 기관라이센스 취득에 필요한 인증
- Medical Device Regulations 2012에 따라 기관 라이센스 (Establishment License)를 취득하고자 하는 자는 적절한 규격의 품질 관리 시스템 (Quality Management Systems : QMS)을 취득하여야 한다.
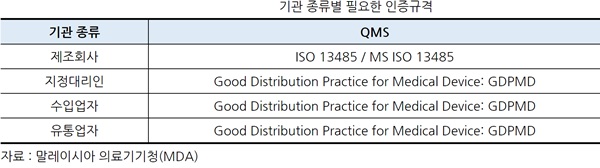
- 기관 라이센스 (Establishment License, EL) 필요한 규격 인증인 GDPMD는 MDA에 등록 된 적합성 평가 기관 (Conformity Assessment Body, CAB)을 통하여 취득할 수 있다.
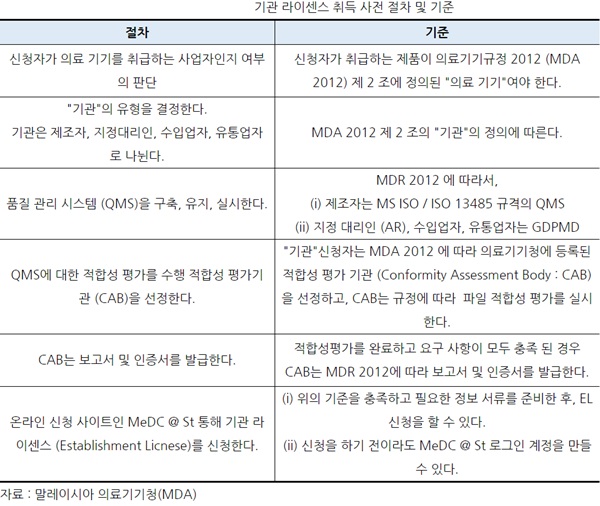
ㅇ 기관 라이센스 취득 사전 절차 및 기준 : 기관라이센스 취득 절차 및 기준은 아래 표와 같다.
작성자 : 메가젠임플란트(말레이시아) 윤영균 법인장 yunidroid88@gmail.com

