이상수의 health policy insight
[Health Policy Insight 178회]
US FDA, AI 및 ML 기반 소프트웨어 의료기기의 변경사항에 대한
규제 프레임워크 제시

메드트로닉코리아
대외협력부 상무
인공지능(artificial intelligence, AI)과 기계학습(machine learning, ML) 기술은 매일 헬스케어를 제공하는 동안 생성되는 방대한 양의 데이터로부터 새롭고 중요한 통찰력을 끌어내어 헬스케어를 변화시킬 잠재력이 있다. 의료기기 제조업체는 이러한 기술을 사용하여 의료공급자를 보다 잘 지원하고 환자 케어를 개선하기 위해 제품을 혁신한다. US FDA는 '의료기기로서의 소프트웨어(software as a medical device, SaMD)'의 안전성과 효과성을 보장하면서도 실세계 학습(real-world learning)과 적응을 통해 변경될 수 있도록 이러한 기술에 대한 '총 제품 수명주기(total product life cycle, TPLC)' 기반 규제 프레임워크(regulatory framework)를 고려하고 있다.
맞춤형(adaptive) AI 및 ML 기술은 환자를 위한 헬스케어의 지속적인 개선을 위해 의료기기 성능을 실시간으로 적응하고 최적화할 가능성이 있다는 점에서 다른 SaMD와 다르다. 국제의료기기규제당국포럼(International Medical Device Regulators Forum, IMDRF)은 SaMD를 하드웨어 의료기기의 일부가 아니면서 이러한 목적을 수행하는 1개 이상의 의료 목적(medical purpose)으로 사용되는 소프트웨어로 정의한다.
'연방 식품, 의약품 및 화장품법(Federal Food, Drug and Cosmetic Act, FD&C Act)'에 의거한 FDA는 의료 목적을 질병이나 기타 질환을 치료, 진단, 치료, 경감 또는 예방하기 위한 목적으로 간주한다. 전통적으로 FDA는 시판전 신고(premarket clearance, 510(k)), De Novo 분류 또는 시판전 허가(premarket approval, PMA)와 같은 적절한 시판전 경로(premarket pathway)를 통해 의료기기를 검토한다. FDA는 변경사항으로 인한 환자에 가해지는 중대성(significance)이나 위험도에 따라 SaMD를 포함한 의료기기의 변경사항을 검토하고 처리한다.
FDA의 의료기기 규제에 대한 전통적인 패러다임은 맞춤형 AI 및 ML 기술을 위해 고안되지 않았다. FDA의 소프트웨어 변경사항에 대한 현행 접근방식에 따라, FDA는 이러한 AI와 ML 기반 소프트웨어의 의료기기로서 변화의 많은 부분이 시판전 검토를 필요할 것으로 예상하고 있다. 2019년 4월2 일, FDA는 "AI/ML 기반 SaMD로서 변경사항에 대한 규제 프레임워크 제안 - 토론 논문 및 의견 요청(Proposed Regulatory Framework for Modifications to Artificial Intelligence/Machine Learning (AI/ML)-Based Software as a Medical Device (SaMD) - Discussion Paper and Request for Feedback)" 토론문(discussion paper)을 발표했다.
이 문서는 AI 및 ML 기반의 소프트웨어 변경에 대한 시판전 검토의 잠재적인 접근법에 대한 FDA의 토대를 기술한다. 토론문에 기술된 아이디어는 현행 시판전 프로그램의 사례를 활용하고 IMDRF의 위험 범주 원칙(risk categorization principles), FDA의 편익-위험 프레임워크(benefit-risk framework), 소프트웨어 수정 지침에 기술된 위험관리 원칙(risk management principles), 조직 기반 전체 제품 수명주기 접근법(organization-based total product lifecycle approach; Digital Health Software Precertification (Pre-Cert) Program에 나와 있음)에 바탕을 두고 있다.
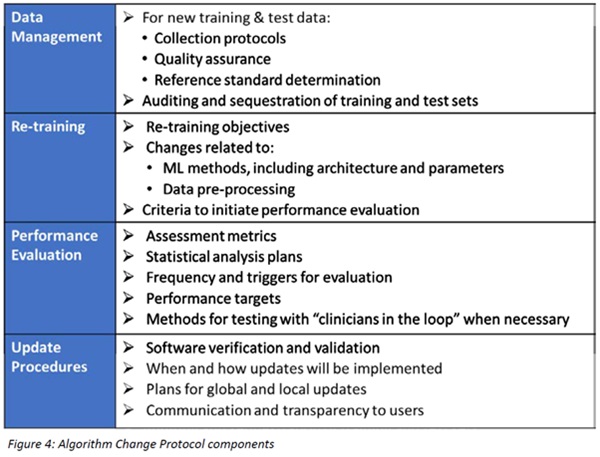
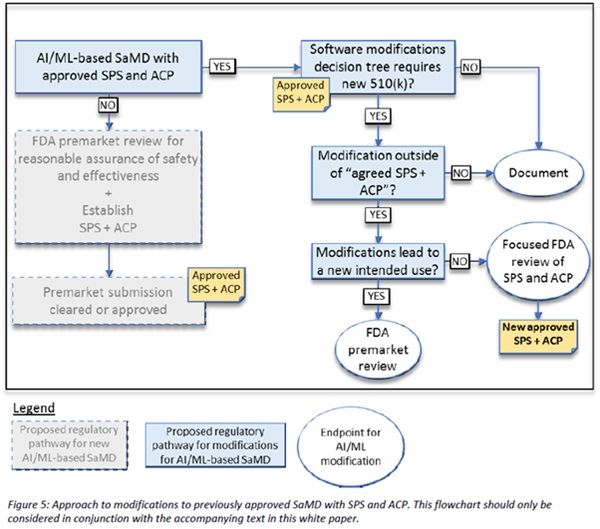
이 프레임워크에서 FDA는 시판전 제출(premarket submissions)에 "예정된 변경관리 계획(predetermined changed control plan)"을 도입했다. 이 계획에는 "의료기기 사전 사양으로서의 소프트웨어(Software as a Medical Device Pre-Specifications)"라고 하는 예상되는 변경 유형과 환자 위험을 관리하는 제어된 방식으로 변경을 시행하는데 사용되는 관련 방법론인 "알고리즘 변경 프로토콜(Algorithm Change Protocol)"이 포함된다.
이 접근법에서 FDA는 AI 및 ML 기반 소프트웨어를 의료기기로 사용하는 투명성과 실세계 성능 모니터링에 대한 제조업체의 약속(commitment)과 승인된 사전사양과 알고리즘 변경 프로토콜의 일부분으로서 시행된 변경에 대해 FDA에 정기적인 업데이트를 기대한다. 제안된 규제 프레임워크는 FDA와 제조업체가 시판전 개발부터 시판후 성능에 이르기까지 소프트웨어 제품을 평가하고 모니터링 할 수 있게 한다. 이러한 잠재적인 프레임워크는 FDA의 규제감독이 환자의 안전을 보장하면서 의료기기로서 AI와 ML 기반 소프트웨어의 반복적인 개선을 수용한다.

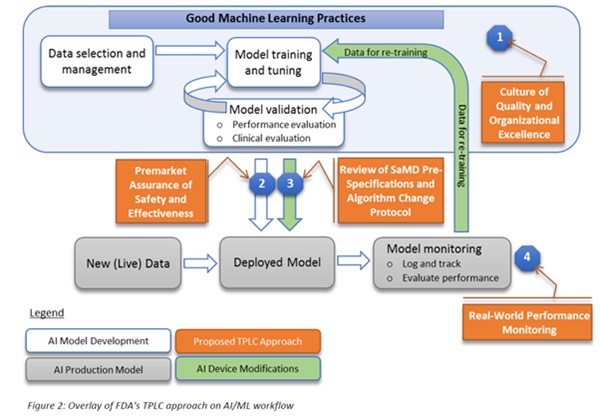

| 시사점 · FDA는 현행 지침에 따라 AI 및 ML 기반 의료기기로서의 소프트웨어에 대한 많은 변화가 시판전 검토 대상이 될 것이라고 예측하고 있으며, 이로 인해 FDA는 이러한 의료기기에 대한 규제 접근방식을 다시 생각하고 있음 |
출처: Proposed Regulatory Framework for Modifications to Artificial Intelligence/Machine Learning (AI/ML)-Based Software as a Medical Device (SaMD): Discussion Paper and Request for Feedback
U.S. Food and Drug Administration. April 2, 2019
https://www.fda.gov/MedicalDevices/DigitalHealth/SoftwareasaMedicalDevice/ucm634612.htm.
https://www.regulations.gov/document?D=FDA-2019-N-1185-0001
* 본 컬럼은 의료기기를 비롯한 헬스케어 분야의 국내외 학회지에 발표된 논문 및 연구보고서 등을 살펴봄으로써 우리나라 의료기기 관련 보건의료정책 마련에 통찰력을 제공하기 위한 목적으로 매주 발표됨

