이상수의 health policy insight : CDRH 규제과학은 의료기기 혁신을 촉진, 최신 기술의 의료기기를 통해 건강을 향상, 유지시켜 보건의료를 발전시키는데 목표를 둠
Health Policy Insight-제51호
US FDA, 2017년 CDRH 규제과학
우선순위(regulatory science priority) 발표
CDRH 규제과학은 의료기기 혁신을 촉진,
최신 기술의 의료기기를 통해 건강을 향상,
유지시켜 보건의료를 발전시키는데 목표를 둠

메드트로닉코리아
대외협력부상무
US FDA의 Center for Devices and Radiological Health (CDRH)는 질병 치료, 예방 및 진단 에 사용되는 의료기기와 방사선발생장치(radiation emitting products)의 안전성, 효과성, 성능 그리고 품질을 확인하는데 책임이 있다. CDRH 규제과학(regulatory science)은 의료기기 혁신을 촉진하고 최신 기술을 이용한 의료기기가 미국인 건강을 향상, 유지시키는데 이용될 수 있도록 함으로써 미국 보건의료(public health)를 발전시키는데 목표를 두고 있다. CDRH는 규제과학을 규제서비스(service of regulation)에서의 과학(science)으로 정의하고 있으며 인허가 의사결정(regulatory decision)이 충분한 근거에 입각하여 이루어지고 제품의 전주기 프레임워크(total life cycle framework) 하에서 의료기기와 방사선발생장치의 안전성, 효과성, 품질 및 성능을 연구하는 도구, 기준 및 방법을 개발하고 적용함으로써 보건의료에 바람직한 영향을 달성하도록 한다. 또한, 시판 전 평가, 시판 후 조사, 규정 준수 및 의사소통에서의 올바른 의사결정을 촉진시키며 공학, 의학, 화학, 독성학, 역학, 통계학 및 사회과학을 포함한 폭넓은 학문분야를 아우른다. CDRH 규제과학 우선순위(regulatory science priority)는 의료기기와 방사선발생장치의 안전성, 효과성, 성능 및 품질을 개선시키고 시장에 혁신적인 의료기기 도입을 촉진하는 촉매제 역할을 하며 가장 중요한 규제과학 간극(gaps) 혹은 니즈에 대한 CDRH 관심에 초점을 맞춘다. 이러한 우선순위는 재평가되며 현행 규제과학 니즈를 반영하기 위해 정기적으로 갱신된다.
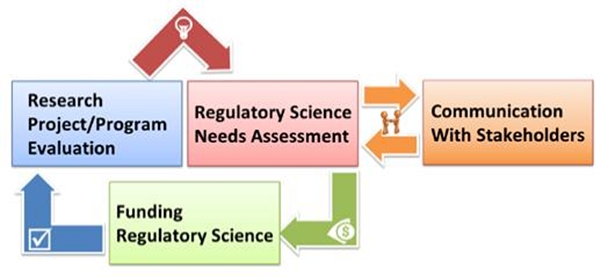
규제과학 우선순위는 CDRH 디렉터(director)와 규제과학소위원회(Regulatory Science Subcommittee, RSS) 공동회장(co-chairs)의 지휘 하에 RSS에 의해 확인된다. RSS는 지난해 우선순위 개발을 위해 이용된 프로세스를 개선하고 최적화하기 위해 직원들로부터 수집한 피드백을 이용한다.
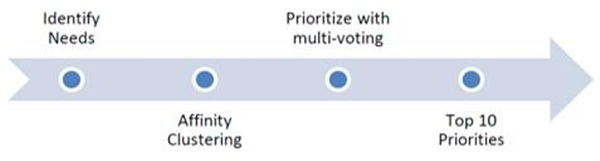
규제과학 니즈는 다음과 같은 기준을 적용하여 규제 및 보건의료 영향에 대해 평가한다.
• 의료기기 혁신을 촉진하고 시장에 새로운 기술 도입을 위한 니즈
• 안전성 및 효과성을 유지하고 의료기기와 방사선발생장치의 이용도를 강화 혹은 촉진하기 위한 니즈
• 조속한 문제 확인을 촉진하고 의료기기와 방사선발생장치의 편익-위험 프로파일(benefit-risk profile)의 시판 후 이해를 개선하고 향후 시판 전 허가를 돕기 위한 니즈
• 이러한 니즈의 보건의료 영향력
2017년 CDRH의 규제과학 우선순위는 다음과 같다.
| 우선순위 | 내용 |
| 1. 인허가 의사결정을 위한 "빅데이터" 활용(leverage) | ·실세계(real-world)경험, 보험, 메디케어 및 메디케이드 청구, 임상연구, 영상 및 차세대 시퀀싱(sequencing)으로부터 구한 데이터는 의료기기 디자인 개선, 인공지능 기기를 위한 훈련도구, 정밀 진단을 개발하는데 사용됨 ·데이터 웨어하우스(data warehouse)로부터 구한 정보는 잠재적으로 도출되는 시판 후 이슈를 감지하는데 유용함 |
| 2. 의료기기 재질의 생물학적 적합성(biocompatibility) 및 생물학적 위험 평가의 현대화 | ·장기간 안전성 및 효과성을 예측하는데 역사적으로 동물시험(animal study)이 사용되어 왔지만, 발암성, 생식독성 및 만성독성은 비용과 시간이 많이 소요되고 많은 수의 동물을 이용한 연구는 때때로 인체 위험 평가(human risk assessment)로 쉽게 전이되는 결과를 제공하지 못함 ·의료기기와 재질의 생물학적 적합성 평가를 현대화하고 변화시키기 위해 좀 더 환자 중심적이고 실세계 의료기기 성능을 예측할 수 있는 새롭고 부담이 적은 접근방식이 필요함 ·의료기기 재질의 생물학적 적합성 검토는 허용기준을 개발하여 강화되며, 화학적 특성, 컴퓨터 모델링, 의료기기 추적감시 및 새로이 도출되고 있는 위험평가 도구를 통합하여 구할 수 있는 다학제적 근거를 포함함 |
| 3. 실세계 근거자료 활용(leverage)과 인허가 의사결정에서 다양한 도메인(domain)을 통한 근거 합성(evidence synthesis)적용 | ·의료기기 사용과 성능에 대한 다양한 관찰데이터는 진료(가령, 전자건강기록 및 청구데이터), 레지스트리(의료기기 시술 및 질병) 및 임상연구(대규모 단순 및 실용적 연구) 데이터베이스 그리고 동료심사된 논문에서 발견됨 ·이러한 데이터는 의료기기 검토 및 평가에서 충분히 활용되고 있지 않고 있으며 실세계 근거자료 활용은 전통적인 임상데이터를 보충하여 인허가 의사결정에 도움이 됨 |
| 4. 의료기기 임상성능을 예측하고 모니터링 하기 위한 시험 및 방법의 발전 | ·의료기기 임상성능을 더 잘 예측, 모니터링하기 위해 전임상 데이터와 의료기기 임상성능 간의 연결고리(link)를 구축하는데 도움이 되는 3가지 규제과학 영역이 확인됨 : 발전된 재질 및 제조공정 영향, 가속화 시험 방법, 스마트 임플란트 모니터링(smart implant monitoring) 효과성 |
| 5. 임상연구 디자인 개선, 간소화하기 위한 방법 및 도구 개발 | ·스크리닝, 진단 혹은 치료목적 의료기기는 충분한 환자를 모집하는데 어려움을 겪고 있는데 낮은 질병 유병율(prevalence)때문임 ·잘못된 가설 혹은 모든 실패모드(failure mode)를 포착하지 못한 연구목적(endpoint)으로 인해 많은 임상연구들이 실패함. 의약품 연구 디자인에서 차용한 위약 대조군(placebo control)의 전통적 개념이 의료기기에서 항상 적용 가능한 것은 아니며 특히 임플란트의 경우 그러함. 이러한 도전과제를 해결하기 위해 개선된 통계방법과 임상연구 디자인 도구가 필요함 ·필요한 도구 및 방법의 예로서 적응임상연구(adaptive clinical trial) 설계, 비열등 마진(non-inferiority margin) 설정을 위한 메타분석(meta-analysis)방법, 희귀질환을 위한 최소한의 환자 수 선정 도구, 그리고 위약 대조군 이용을 위한 새로운 방법 |
| 6. 인허가 의사결정을 지원하기 위한 컴퓨터 모델링 개발 | ·의료영상을 위한 발전된 기상 및 하이브리드 임상연구(virtual and hybrid clinical trial)는 새로운 시스템, 프로토콜, 질병 스크리닝 및 진단을 평가함 ·임플란트 시뮬레이션을 개선시켜, 임상적 성능 및 안전성을 더 잘 예측하고, 현행 비임상 벤치시험(bench test)에서 포착되지 않는 이상반응을 확인함 ·정교한 도구는 의료기기 평가를 강화하고 가속화시키는 잠재력을 갖고 있으며 임상연구에 초점을 맞추고 간소화시킬 수 있음. 특히, 질병이 낮은 유병율을 갖고 있거나 이식된 의료기기가 수년에 걸쳐 기능을 수행할 경우 그러함 |
| 7. 디지털 헬스 성과 강화 및 의료기기 사이버보안(cybersecurity) 강화 | ·디지털 헬스와 사이버보안은 의료기기에 영향을 끼치며 급속히 성장하고 있는 분야임. 환자 정보를 저장하는 의료긱는 점차 다른 의료기기, 내부 네트워크, 인터넷 혹은 휴대용 미디어(portable media)에 연결되며 사이버보안 위협에 노출되고 있음 ·이러한 기술을 확보하고 기술적 환경이 원하는 보건의료 영향을 달성할 수 있도록 하기 위해, 의료기기 및 소프트웨어의 성능과 사이버보안을 강화하기 위한 연구가 필요함 ·이러한 목적을 달성하기 위한 한가지 방법은 어떠한 항목의 소프트웨어 변경이 의료기기 안전성 혹은 효과성에 대해 유의한 악영향을 끼치는지 확인하기 위한 연구를 수행하여 헬스케어 환경의 독특한 고려사항을 포함한 정보기술 취약성을 평가하기 위한 표준화된 방법으로서 공통의 취약성평가시스템(common vulnerability scoring system)에 적응하기 위해 필요한 연구임 |
| 8. 항균제의 효과성, 멸균 및 의료기기 재처리(reprocessing)를 더 잘 이해하여 의료관련감염(healthcare associated infection HAI)감소 | ·감염된 물질과 의료기기와의 접촉은 의료관련감염의 주요 원인임 ·주요 보건의료 도전과제를 해결하는데 돕기 위해, CDRH는 3가지 영역의 규제과학 적용에 관심을 두고 있음 : 의료기기에 부가된 항균제, 이식형 의료기기 멸균, 재사용 가능한 의료기기 재처리 |
| 9. 인허가 의사결정에서의 환자 의견 수립 및 이용 | ·환자중심 의료제품 개발을 촉진하고 환자중심 제도(patient-centric regulation)를 알리기 위해 환자들은 점차 자신들의 의견을 제공하고 있음 |
| 10. 정밀의학(precision medicine)및 의료기기 성능, 질병 진단 및 진행 예측을 위한 바이오마커(biomarkers) 이용 | ·의료기기 라이프사이클 중 정밀의학에 대한 강조는 더 우수한 집중적인 적응중(focused indication)과 임상연구, 그리고 의료기기 최적화(optimization)를 얻는 수단임 ·정밀의학을 위한 규제과학은 의료기기를 시험하기 위한 환자 특이적 세포 모델 개발과 같은 연구 노력을 포함함 ·이러한 노력은 의료기기-의약품 교호작용(interaction)을 예측하는 비임상적 방법과 정밀의학에서 줄기세포 진단시험을 위한 과학적 기반을 제공 ·의료기기 관련 바이오마커의 효율적인 발견과 임상 및 인허가 의사결정을 위한 바이어마커 기반 기능적 근거(functional evidence) 창출은 빅데이터의 반복된 이용과 통합을 필요로 함 |
| 시 사 점 • 규제과학 우선순위는 의료기기 혁신을 촉진하고 시장에 새로운 기술 도입을 위한 니즈를 뒷받침하기 위한 노력의 일환임 |
논문 출처 : FY2017 Regulatory Science Priorities
US FDA CDRH; September 2016
http://www.fda.gov/MedicalDevices/ScienceandResearch/ucm467550.htm
"본 컬럼은 의료기기를 비롯한 헬스케어 분야의 국내외 학회지에 발표된 논문 및 연구보고서를 살펴봄으로써 우리나라 의료기기 관련 보건의료정책 마련에 통찰력을 제공하기 위한 목적으로 매주 발표됨"

